سه شنبه, ۱۱ اردیبهشت, ۱۴۰۳ / 30 April, 2024
مجله ویستا
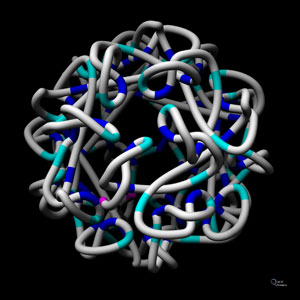
سیم حیات و گوانینهای فداکار

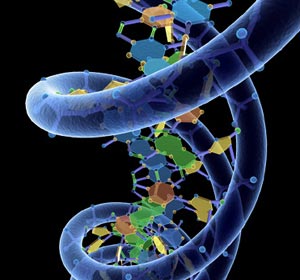
به نظر میرسد، در سلولهای زنده نیز DNA دو رشتهای بار الکتریکی را در فاصلههای طولانی جابهجا میکند. اکنون محققان بسیاری تصور میکنند، این پدیده نقش زیستی نیز دارد. به نظر آنان، طبیعت از این ویژگی DNA در جایی بهره برده است. یکی از آنها میتواند در فرایند آسیب و ترمیم DNA باشد. به طور معمول، بسیاری از آسیبهایی که به ژنها وارد میشوند، از سطح الکترون آغاز میشوند؛ یعنی، زمانی که رادیکالهای آزاد و سایر فراوردههای جانبی و در عین حال بسیار واکنشگر سوخت و ساز سلولی، از مارپیچ دوتایی الکترون غارت میکنند.
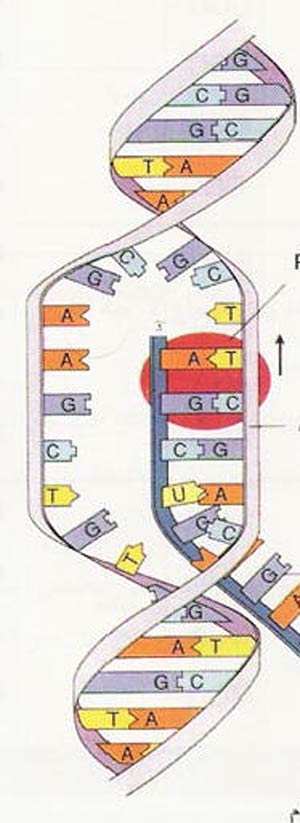
«بازگوانین» هدف سادهای برای این «تخریب اکسیداتیو» است، زیرا یکی از الکترونهای این باز نسبت به الکترونهای سر باز دیگر، ارتباط ضعیفتری با مولکول دارد. از دست دادن این الکترون میتواند، باعث بروز مشکلاتی جدی شود. زیرا گوانین اکسید شده با آب واکنش میدهد و در نتیج هی آن، مولکولهای مخربی تشکیل میشوند. ۸- اکسوگوانین ( ۸-oxoG ) معمولترین آنهاست که به طرز نادرستی، با آدنین و نیز جفت عادی گوانین یعنی سیتوزین، پیوند برقرار میکند. از این رو، اگر سلولی که دارای ۸- اکسوگوانین است، تقسیم شود، به احتمال پنجاه درصد در موقعیت سیتوزین، باز آدنین را خواهد داشت. به عبارت دیگر، یک جهش رخ خواهد داد.
سلولها برای شناسایی و برطرف کردن آسیبهای اکسیداتیو، از سازوکارهای متفاوتی بهره میگیرند. اما این سیستمهای امنیتی نمیتوانند از پس هم هی آسیبها برآیند و این جهشهای حاصل از عوامل اکسید کننده، از جمله عل تهای اصلی ایجاد سرطان، بیماریهای ژنتیکی و مرگ سلولها هستند.
از آن جا که آسیبهای اکسیداتیو اهمیت زیادی دارند، زیست شیمیدانها مدتهاست تلاش میکنند، به چگونگی وقوع این فرایند پی ببرند. آغاز این تلاشها به ده هی ۱۹۶۰ بر میگردد؛ هنگامی که آنان در یافتند، اگر DNA هادی جریان الکتریکی باشد، میتواند بر این فرایند تأثیر ژرفی بگذارد. از دست دادن یک الکترون، جای خالی یا «حفرهای» را بر جای میگذارد که میتواند در سرتاسر یک هادی جابهجا شود. اگر DNA بهراستی توانایی هدایت جریان الکتریکی را داشته باشد، آسیب اکسیداتیو میتواند در طول رشتههای DNA جا به جا شود و در موقعیتهای دیگر که ممکن است بسیار دورتر از نقط هی آغاز حمله باشند، ۸- اکسوگوانین تولید کند.
در سال ۱۹۹۶، گروهی از پژوهشگران ثابت کردند، آسیبهای اکسیداتیو میتوانند در فاصل هی دور رخ دهند. آنان از یک عامل اکسید کنن دهی ویژه استفاده کردند که برای جذب الکترون از گوانینی خاص طراحی شده بود. سپس نشان دادند که آسیب میتواند، در فاصلهای به انداز هی ۱۱ جفت باز از نقط هی آغاز حمله رخ دهد. برای این پدیده تنها یک توجیه وجود داشت: «حفرهها» در طول DNA جابهجا میشوند. پژوهشگران دیگری نشان دادهاند که حفرهها حتی میتوانند حدود ۶۰ جفت باز یا بیشتر جابهجا شوند. به لحاظ نظری، این جابهجایی میتواند تا حدود ۱۰۰ جفت باز نیز رخ میدهد. به علاوه، مهاجرت حفرهها ممکن است در هس هی سلولهای زنده نیز رخ دهد.
اهمیت زیستی این پدیده چیست؟ در سال ۱۹۹۹، زیست شیمیدانها نظری هی نوآورانهای را مطرح کردند و جابهجای حفرهها را در خط مقدم مبارزه با تخریب DNA قرار دادند. به نظر آنان، تخریب اکسیداتیو در نهایت، به نخستین گوانین از توالی GG آسیب میرساند. از لحاظ شیمیایی، این رویداد معنادار است؛ گرفتن یک الکترون از دو گ وانینی که پشت هم قرار دارند (یعنی GG )، از یک گوانین منفرد آسانتر است؛ زیرا پتانسیل اکسیداسیون پا ی ینتری دارد. به علاوه، آزمایشها نشان دادهاند، توالیهای GGG آسانتر از توالیهای GG دچار آسیب اکسیداتیو میشوند؛ زیرا در این حالت باز هم پتانسیل اکسیداسیون کاهش مییابد.
به نظر میرسد ، وقتی در نقطهای از DNA آسیب اکسیداتیو ایجاد میشود و در پی کم شدن الکترون در آن جا به اصطلاح حفرهای ایجاد میشود، حفره در امتداد رشت هی DNA جابهجا میشود تا به توالی GG یا GGG برسد. در این نقطه، ح ف ره متوقف میشود تا یک مولکول آب وارد عمل شود و یک آسیب پایدار به وجود آید.
این فرایند ما را به یاد اثر حفاظت کاتدی میاندازد؛ یعنی استفاده از یک ماده با پتانسیل اکسیداتیو پا ی ین برای محافظت از فلز دیگر. این روش، نخستین بار در سال ۱۸۲۴ میلادی به کار رفت. در آن سال، از فلز روی یک حفاظت از بدن هی فولادی کشتیهای جنگی انگلیس استفاده شد. امروزه در فرانید گالوانیزه کردن، از فلز روی برای جلوگیری از زنگ زدن آهن استفاده میشود.
به نظر میرسد، انتقال بار الکتریکی در DNA نیز همین نقش را داشته باشد. اگر توالیهای GG و GGG ، نسبت به آسیب اکسیداتیو حساسیت بیشتری داشته باشند. باید همانند دانههای تسبیح در چنان موقعیتهای راهبردی ردیف شده باشند. که بتوانند آسیب اکسیداتیو را از نواحی رمز دهنده به نواحی غیر رمزدهند هی DNA جابهجا کنند. به این ترتیب، نواحی مهم DNA در امان میمانند و آنزیمهای ترمیم کننده فرصت مییابند نواحی آسیب دیده را ترمیم کنند.
ژنتیکدانان مدتهاست با این معما روبه رو هستند که چرا ژنهای یوکاریوتها این همه نواحی غیر رمز دهنده (مانند اینترونهایی که لابهلای اگزونها هستند) دارند. گروهی از محققان در سال ۲۰۰۱ گزارش کردند، در حاشی هی ا ین ترونها مقدار زیادی باز G ، همانند دانههای تسبیح ردیف شدهاند. این جا همان جایی است که میتوانند جهشها را ببلعند تا نواحی حساس درامان بمانند. پژوهشگران همچنین یادآور شدند که اگزونها در انسان به طور معمول ۱۸۰-۱۵۰ جفت باز طول دارند. همان طور که پیش از این گفتیم، به لحاظ نظری، حفرهها میتوانند تا ۱۰۰ جفت باز جابهجا شوند. بنابراین به نظر میرسد، گوانینهای فداکار در موقعیت مناسبی قرار گرفتهاند.
حافظت کاتدی به راستی نظر قشنگی است و میتواند یکی از نقشهای DNA غیر رمزده ن ده (یا به تعبیری غیر منصفانه DNA آشغال) باشد هر چند این نظر منطقی به نظر میرسد، اما به شواهد محکمتری نیاز دارد و باید به برخی ابهامات نیز پاسخ دهد. برای مثال، فراوانی گوانین در لبههای اینترون - اگزون را میتوان به نقش آنها در فرایند پیرایش DNA (حذف ا ی نترونها و اتصال اگزونها) نسبت داد. در واقع، در این موقعیتها، توالیهای غنی از گوانین به عنوان پیامی برای آنزیمهای پیرایشگر DNA عمل میکنند. به علاوه، دادههای مربوط به ژنوم انسان به ژنوم بیمهرگان قابل تعمیم نیست، زیرا براساس پژوهشها به نظر میرسد، ژنوم آنها در مرز اگزونها و اینترونها فاقد توالیهای غنی از گوانین است.
از طرف دیگر، آب در هسته بسیار کمیاب است. بنابراین، شاید حفرهها بتوانند پیش از واکنش دادن با یک مولکول آب، فاص هی بیشتری را طی کنند و در نقطهای فراتر از مرز اگزون - اینترون به DNA آسیب برسانند. به علاوه، شواهدی وجود دارند مبنی بر این که هدایت الکتریکی DNA در حالت بلوری (کم آب) افزایش مییابد. جالبتر این که باکتریها در شرایط تنشزا پروتئینی تولید میکنند که باعث القای بلوری شدن DNA میشود. آیا این کار راهی برای جلوگیری از آسیب به DNA نیست؟
انتقال بار الکتریکی ممکن است نقش زیستی دیگری نیز داشته باشد. تنها حفرههای الکترونی نیستند که در طول DNA جابهجا میشوند، بلکه فیزیکدانان معتقدند، الکترونهای آزاد نیز چنین میکنند. الکترونها در ترمیم DNA نقش مهمی دارند و بسیاری از آنزیمهای ترمیم کننده برای برطرف کردن آسیب، به آنها الکترون میدهند. برخی از پژوهشگران این فرض را پیشنهاد کردهاند که این آنزیمها از خاصیت هادی بودن DNA سود میجویند و الکترونها را از راه این سیم زنده از فاصلههای مختلف به جای مورد نیاز میفرستند. این فرض یکی از معماهای بزرگ فرایند ترمیم DNA را حل میکند؛ آنزیمهای ترمیم کننده چگونه به موضع آسیب دیده دسترسی پیدا میکنند؟
در سلولهای زنده، DNA همراه با پروتئینهای هسیتون، به صورت یک ابرمارپیچ غیر قابل نفوذ سازمان یافته است. بنابراین، دسترسی آنزیمها به جایگاهی که نیاز به ترمیم دارد، بدون انتقال بار الکتریکی، سخت به نظر میرسد. دانشمندان مولکولهایی طراحی کردهاند که کار تعمیر DNA را در فاصلههایی دورتر از محل ضایعه انجام میدهند. به نظر میرسد، آنزیمهای طبیعی نیز همینگونه عمل میکنند.
پیش از این تصور میشد، خاصیت انتقال بار الکتریکی برای سلول استفادهای ندارد، اما اکنون به نظر میرسد این کار، برای DNA دو رشتهای یک توانایی کلیدی است.
منبع:
Graham Lawton, Live Wire, New Scientist, ۱۵ March ۲۰۰۳
Graham Lawton, Live Wire, New Scientist, ۱۵ March ۲۰۰۳
منبع : جزیره دانش
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
خلیج فارس مجلس حجاب مجلس شورای اسلامی روز معلم بودجه شورای نگهبان دولت سیزدهم مجلس یازدهم جمهوری اسلامی ایران قالیباف جهان
پایتخت سلامت تهران شهرداری تهران هواشناسی فضای مجازی شورای شهر شورای شهر تهران سیل قتل پلیس وزارت بهداشت
خودرو ارز دولت قیمت دلار ایران خودرو قیمت خودرو مالیات دلار بازار خودرو بانک مرکزی قیمت طلا مسکن
مهران مدیری تلویزیون سریال رسانه تئاتر سینمای ایران فیلم سینما موسیقی سریال پایتخت
سازمان سنجش انتخاب رشته
غزه جنگ غزه رژیم صهیونیستی فلسطین آمریکا حماس روسیه عربستان نوار غزه اوکراین ترکیه عراق
فوتبال استقلال پرسپولیس سپاهان تیم ملی فوتسال ایران تراکتور فوتسال بازی وحید شمسایی باشگاه پرسپولیس باشگاه استقلال لیگ برتر
هوش مصنوعی اپل اینستاگرام همراه اول تبلیغات گوگل ایرانسل فناوری روزنامه آیفون
ویتامین مواد غذایی سازمان غذا و دارو طول عمر سلامت روان بارداری پرستار دندانپزشکی هندوانه