شنبه, ۸ اردیبهشت, ۱۴۰۳ / 27 April, 2024
مجله ویستا
مقایسه یافته های هیستوپاتولوژیک در مخاط غیر تومورال معده افراد مبتلا به سرطان معده و افراد مبتلا به سوء هاضمه
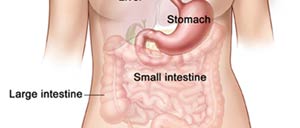
سرطان معده دومین علت مرگ ناشی از سرطان را در جهان به خود اختصاص داده و معمولاً پیش آگهی بدی دارد . بروز آن در برخی کشورها همچون آمـــریکا و انگلیس کاهش یافته امـــا در بسیـــاری کشورها همچون ژاپن، چین، ایتالیا و کشورهای در حال توسعه همچنان در حد بالایی قرار دارد .عوامل خطر متفاوتی که عمدتاً رفتاری و تغذیه ای می باشند، در خصوص ایجاد سرطان معده مطرح گردیده است و در کنار آنها برخی تظاهرات هیستوپاتولوژیک مستعد کننده نیز گزارش گردیده است که در خصوص وجود و یا میزان تأثیر آنها اختلاف نظراتی وجود دارد. مطالعاتی که در مناطق با شیوع بالای سرطان معده انجام یافته بر این باورند که برخی عوامل محیطی از جمله سیگار کشیدن و غذاهای نمکدار و سابقه خانوادگی جهت سرطان معده خطرزا بوده و بر اثر این عوامل و بعضی تغییرات ژنتیکی مستعد کننده، ضایعات پیش سرطانی (Precancerous) به وجود آمده که طی مراحلی به سمت سرطان معده پیشرفت می نماید . برخی مطالعات در خصوص یافته های پاتولوژیک مرتبط با سرطان معده از قبیل متاپلازی روده ای، عفونت هلیکوباکتر پیلوری، گاستریت آتروفیک، دیسپلازی، ائوزینوفیلی، گاستریت حاد و فولیکول لنفاوی را مرتبط با سرطان معده و در بعضی موارد نتایج متضادی به دست آورده اند .تعیین ضایعات پاتولوژیک مرتبط با سرطان معده جهت ایجاد برنامه های غربالگری و تشخیص زود هنگام و در نتیجه اعمال اقدامات پیشگیرانه و پیگیری دقیق تر بیماران، با توجه به تشخیص دیر هنگام (به دلیل علایم بالینی تشخیص دیر هنگام همچون انسداد و همخوانی بسیاری از علایم با ضایعات خوش خیم) و پیش آگهی بد آن از اهمیت به سزایی برخوردار می باشد. لذا بر آن شدیم تا در این مطالعه به بررسی برخی ضایعات هیستوپاتولوژی مرتبط با سرطان معده بپردازیم.
● روش بررسی:
این تحقیق یک مطالعه مورد- شاهدی می باشد. گروه مورد شامل ۵۵ بیمار مبتلا به سرطان معده سلول های اپیتلیال اعم از نوع منتشر (۷ مورد) و یا نوع روده ای (۴۸ مورد) بود که در آزمایشگاه بیمارستان الزهراء(س) شهر اصفهان توسط دو نفر پاتولوژیست تشخیص داده شدند. برای بررسی تغییرات هیستولوژیک در نمونه های سرطان معده اسلایدهای نواحی غیر تومورال انتخاب شد. گروه شاهد نیز به همین تعداد نمونه از موارد غیر از سرطان معده و زخم و افراد مبتلا به سوء هاضمه از نمونه های ارجاع شده به آزمایشگاه همان بیمارستان انتخاب گردید. تعداد سه تا پنج بیوپسی از نواحی ملتهب ناحیه آنتر جهت شناسائی هلیکوباکتر پیلوری گرفته شد. سپس در خصوص کلیه افراد مورد پژوهش علاوه بر تعیین خصوصیات دموگرافیک، شاخص های گاستریت آتروفیک (کاهش بافت ترشحی مخاط معده)، متاپلازی روده ای (جایگزینی اپی تلیوم معده توسط اپی تلیوم روده ای)، دیسپلازی (تغییرات ساختمانی و سیتولوژیک در اپی تلیوم غددی بصورت آتیپی سلولی و نامنظمی و مطبق کاذب شدن ساختار غددی)، گاستریت مزمن (حضور بیش از پنج سلول التهابی مزمن در لامیناپروپریا در بزرگنمایی ۴۰۰) فولیکول لنفاوی (تجمعات لنفاوی با تشکیل مراکز زایگر) و انفیلتراسیون ائوزینوفیلی (حضور تعدادی ائوزینوفیل در لامینا پروپریا یا حضور در داخل اپی تلیوم سطحی) و وجود ارگانیسم هلیکوباکترپیلوری توسط دو پاتولوژیست و بر اساس رنگ آمیزی هماتوکسیلین - ائوزین (برای هلیکوباکتر پیلوری توسط رنگ آمیزی گیمسا) و با استفاده از درشت نمایی های ۴، ۱۰ و ۴۰ بررسی گردید. در آنالیز نتایج از نرم افزار SPSS و شاخص های فراوانی، جهت تعیین وجود ارتباط بین متغیرهای کیفی از تست مجذور کای و جهت مقایسه سن در دو گروه مورد و شاهد بر اساس نتیجه قسمت های کولموگرنو- اسمیرنو از تست من ویتنی استفاده گردید. جهت تعیین شدت ارتباط از شاخص نسبت شانس به همراه ۹۵ درصد فاصله اطمینان آن و کسر خطر (Attributable fraction) استفاده شد. محققین در کلیه مراحل تحقیق متعهد به اصول اخلاقی اعلامیه وزارت بهداشت، درمان و آموزش پزشکی بودند.
● یافته ها:
در نگاه کلی به نتایج محققین ۵/۲۴ درصد از افراد گروه مورد و ۳/۴۷ درصد از افراد گروه شاهد مؤنث بودند (۰۱/۰>p). میانگین سن در گروه مبتلا به سرطان معده ۳/۶۰ (۳/۶۲-۳/۵۸) سال و در گروه کنترل ۶/۵۳ (۵/۵۵- ۷/۵۱) سال بود (۰۱/۰>p). در بررسی لامها ۱/۴۹ درصد از افراد گروه مورد و ۴۰ درصد از افراد گروه شاهد، گاستریت آتروفیک مشاهده گردید که این میزان به لحاظ آماری معنی دار نمی باشد. ۳/۴۷ درصد از افراد گروه مورد و ۹/۱۰ درصد از افراد گروه شاهد دچار متاپلازی روده ای بودند که این میزان ها به لحاظ آماری دارای اختلاف معنی داری بودند (۰۰۱/۰p<، ۳۲/۷ OR=). به ترتیب ۵/۱۴ و ۸/۱ درصـد از افراد گروه مورد و شاهد دارای دیسپلازی بودند (۰۱/۰p<، ۱۹/۹OR=). در بررسی لام های پاتولوژی ۱/۲۹ درصد از افراد گروه مورد، گاستریت متوسط و شدید وجود داشت. این در حالی است که در گروه کنترل ۱/۴۹ درصد دارای این خصوصیت بودند (۰۵/۰>p، ۴۳/۰OR=). ۸/۸۱ درصد افراد گروه مورد و ۷/۳۲ درصد گروه شاهد در بررسی میکروسکوپی نمونه دارای فولیکول لنفاوی بودند (۰۰۱/۰p<، ۲۵/۹OR=). به ترتیب ۶/۴۳ و ۸/۴۱ درصد افراد گروه مورد و شاهد در بررسی لام های خود دارای انفیلتراسیون ائوزینوفیلی بودند که اختلاف آماری معنی داری بین دو گروه وجود ندارد. در ۴۲ درصد لام های رنگ آمیزی شده به وسیله گیمسا در گروه مورد، ارگانیسم هلیکوباکتر پیلوری مشاهده شد و در گروه شاهد نیز با همین روش رنگ آمیزی در ۴۰ درصد موارد ارگانیسم هلیکوباکتر پیلوری رویت گردید که میزان وجود این ارگانیسم در دو گروه اختلاف آماری معنی داری ندارد (جدول شماره ۱).
جدول شماره ۱ : مقایسه عوامل خطر پاتولوژیک در دو گروه مورد و شاهد
۵۵n= در دو گروه
گروه مورد: دارای سرطان معده
گروه شاهد: فاقد سرطان معده
OR=Odds Ratio
● بحث:
بسیاری از محققین ایجاد سرطان معده را همچون پولیپ های آدنوماتوی روده، محصول پیشرفت وقایع متوالی به صورت متاپلازی روده ای، آتروفی، دیسپلازی و در نهایت آدنوکارسینوم می دانند .در این مطالعه ارتباطی بین گاستریت آتروفیک و سرطان معده مشخص نگردید این در حالی است که در برخی مطالعات هم گروهی بین گاستریت آتروفیک و ایجاد سرطان معده، ارتباط قوی آماری گزارش گردیده است .یکی از دلایل این اختلاف نوع مطالعه انجام شده (مورد – شاهدی) در مقایسه با مقالات اشاره شده (هم گروهی) می باشد. یکی از مهمترین وقایع ایجاد شده در گاستریت آتروفیک، فقدان سلول های پاریتال تولید کننده اسید می باشد. مطالعات اخیر بر روی مدل های حیوانی نشان داده اند که فقدان این سلول ها سبب آمپلیفیکاسیون سلولهای بنیادی یک یا چند منظوره معده که رسپتور گلیکان سیالیهدرات بروز می دهند می شود .همچنین همراهی عفونت هلیکوباکتر با گاستریت آتروفیک سبب استعداد بیشتر ایجاد سرطان معده می گردد که با توجه به عدم وجود اختلاف معنی دار وجود هلیکوباکتر پیلوری در دو گروه این مطالعه شاید یکی دیگـــر از دلایل ایجـــاد این نتیجه در مقایسه با سایر تحقیقات باشد. در این تحقیق متاپلازی روده ای به عنوان یکی از قوی ترین عوامل خطر سرطان معده مشخص گردیده است. در مطالعات اخیر دیگر نیز اکثراً بر این مطلب صحه گذارده اند .
همچنین در برخی مطالعات مطرح گردید که وجود عفونت هلیکوباکتر پیلوری، جنسیت مرد و سن بالا از مهمترین عوامل خطر تبدیل متاپلازی روده ای به سمت سرطان معده می باشد. همچنین در مطالعات حیوانی نقش نقص یا فقدان و موتاسیون ژن APC در مدل های حیوانی به عنوان کارسینوژنز در سرطان معده و تبدیل متاپلازی روده ای به سرطان معده اثبات شده است . در یک مطالعه نیز میزان مثبت شدن p۵۳ در سرطان معده بیش از متاپلازی روده ای و میزان مثبت شدن bcl-۲ در متاپلازی روده ای بیشتر از سرطان معده بوده است . از نکات جالب توجه دیگر، ارتباط بین گاستریت آتروفیک و متاپلازی روده ای با نوع روده ای سرطان معده می باشد. همچنین عنوان شده که گاستریت مزمن شدید معمولاً در ارتباط با سرطان معده از نوع منتشر می باشد. دیسپلازی نیز به عنوان عامل خطر مهم دیگر در این مطالعه معین گردید که در سیر پیشرفت گاستریت آتروفیک و متاپلازی روده ای به سمت سرطان معده نقش میانی دارد .عفونت هلیکوباکتر پیلوری در این مطالعه ارتباطی با ابتلا به سرطان معده نداشت که در برخی مطالعات نتیجه مشابه این مطالعه حاصل گردیده است . اما در برخی دیگر بر ارتباط عفونت با این ارگانیسم و ایجاد سرطان معده تأکید گردیده است و آنچه که از مرور متون بر می آید همراهی هلیکوباکتر پیلوری با گاستریت آتروفیک و متاپلازی روده ای باعث اثر مستعد کنندگی اضافی در جهت سرطان معده می گردد .از سایر عوامل خطر هیستوپاتولوژیک سرطان معده در این مطالعه، وجود فولیکول لنفاوی در بافت بود. در مطالعات دیگر به این مطلب اشاره نگردیده و تنها در یک پان گاستریت وجود فولیکول لنفاوی در افراد دارای سابقه فامیلی کارسینوم معده بیشتر از افراد بدون این سابقه بوده است .لذا پیشنهاد می گردد در مطالعات مشابه دیگر به تعیین وجود یا عدم وجود نقش فولیکول لنفاوی در ایجاد سرطان معده پرداخته شود.
در این مطالعه وجود انفیلتراسیون ائوزینوفیلی در بافت معده نقش تعیین کننده ای به عنوان عامل خطر سرطان معده نداشت. در مطالعات دیگر نیز گرچه وجود ائوزینوفیلی در خون محیطی و بروز عوامل کموتاکتیک ائوزینوفیل در همراهی با سرطان معده گزارش گردیده است ، انفیلتراسیون ائوزینوفیل در بافت معده را تنها به عنوان یک عامل پروگنوستیک خوب جهت پیشگویی بقای بیشتـر بیمـــاران مبتــلا به ســـرطان معده گزارش کرده اند.
● نتیجه گیری:
با توجه به ارتباط قوی وجود متاپلازی روده ای، دیسپلازی و فولیکول لنفاوی در بیوپسی معده مبتلایان به سرطان معده، نیاز به پیگیری منظم و در فواصل کوتاه مدت این بیماران از طرف پزشک می باشد.
دکتر محمد حسین صانعی، دکتر بهنام صانعی، دکتر پروین محزونی، دکتر علی چهره ای استادیار گروه پاتولوژی - دانشگاه علوم پزشکی اصفهان، استادیار گروه جراحی – دانشگاه علوم پزشکی شهرکرد، دستیار پاتولوژی -دانشگاه علوم پزشکی اصفهان.
منابع:
۱.Pellicano R, Fagoonee S, Palestro G, Rizzetto M, Ponzetto A. Intestinal metaplasia, dysplasia, gastric cancer and Helicobacter pylori: epidemiological observations. Minerva Med. ۲۰۰۵ Feb; ۹۶(۱): ۱-۱۰.
۲.Devesa SS, Blot WJ, Fraumeni JF Jr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer. ۱۹۹۸ Nov; ۸۳(۱۰): ۲۰۴۹-۵۳.
۳.Noguchi Y, Yoshikawa T, Tsuburaya A. Is gastric carcinoma different between Japan and the United States? Cancer. ۲۰۰۰; ۸۹: ۲۲۳۷-۴۶.۴.You WC, Li JY, Zhang L, Jin ML, Chang YS, Ma JL, et al. Etiology and prevention of gastric cancer: a population study in a high-risk area of China. Chin J Dig Dis. ۲۰۰۵; ۶(۴): ۱۴۹-۵۴.۵. Mutoh H, Sakurai S, Satoh K, Tamada K, Kita H, Osawa H, et al. Development of gastric carcinoma from intestinal metaplasia in Cdx۲-transgenic mice. Cancer Res. ۲۰۰۴ Nov; ۶۴(۲۱): ۷۷۴۰-۷.
۶.Kato S, Nakajima S, Nishino Y, Ozawa K, Minoura T, Konno M, et al. Association between gastric atrophy and Helicobacter pylori infection in Japanese children: a retrospective multicenter study. Dig Dis Sci. ۲۰۰۶ Jan; ۵۱(۱): ۹۹-۱۰۴.۷.Pasechnikov VD, Chukov SZ. Kotelevets SM .Mostovov AN. Mernova VP. Possibility of non-invasive diagnosis of gastric mucosal precancerous changes. World J Gastroenterol. ۲۰۰۴ Nov; ۱۰(۲۱): ۳۱۴۶-۵۰.
۸.Fukuda S, Tanaka M, Soma Y. Histological analysis of gastritis and Helicobacter pylori infection in patients with early gastric cancer. J Gastroentral Hepatol. ۲۰۰۰; ۱۵(۱۲): ۱۳۷۰-۶.
۹.Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston ۱۹۹۴. Am J Surg Pathol. ۱۹۹۶ Oct; ۲۰(۱۰): ۱۱۶۱-۸۱
۱۰.Lauwers GY. Defining the pathologic diagnosis of metaplasia, atrophy, dysplasia and gastric adenocarcinoma. J Clin Gastroenterol. ۲۰۰۳ May-Jun; ۳۶(۵ Suppl): S۳۷-۴۳; discussion S۶۱-۲.
۱۱.Dinis-Ribeiro M, Lopes C, da Costa-Pereira A, Guilherme M, Barbosa J, Lomba-Viana H, et al. A follow up model for patients with atrophic chronic gastritis and intestinal metaplasia. J Clin Pathol. ۲۰۰۴ Feb; ۵۷(۲): ۱۷۷-۸۲.
۱۲.Zhang C, Yamada N, Wu YL, Wen M, Matsuhisa T, Matsukura N. Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cancer. World J Gastroenterol. ۲۰۰۵ Feb; ۱۱(۶): ۷۹۱-۶.
۱۳.Piscoya Rivera A, Bussaleu A, Cok J. Comparison of the histopathological finding among the biopsy of non cancerous gastric mucosa of patient with gastric cancer and the biopsy of gastric mucosa of dyspeptic patient without gastric cancer. Rev Castroenterol Peru. ۲۰۰۱; ۲۱(۲): ۱۰۷-۱۴.
۱۴.Oh JD, Kling-Backhed H, Giannakis M, Engstrand LG, Gordon JI. Interactions between gastric epithelial stem cells and Helicobacter pylori in the setting of chronic atrophic gastritis. Curr Opin Microbial. ۲۰۰۶ Feb; ۹(۱): ۲۱-۷.
۱۵.Ohata H, Kitauchi S, Yoshimura N, Mugitani K, Iwane M, Nakamura H, et al. Shimizu progression of chronic atrophic gastritis associated with Helicobacter pylori infection increases risk of gastric cancer. Int J Cancer. ۲۰۰۴ Mar; ۱۰۹(۱): ۱۳۸-۴۳.
۱۶.Leung WK, Ng EK, Chan WY, Auyeung AC, Chan KF, Lam CC, et al. Risk factors associated with the development of intestinal metaplasia in first-degree relatives of gastric cancer patients. Cancer Epidemiol Biomarkers Prev. ۲۰۰۵ Dec; ۱۴(۱۲): ۲۹۸۲-۶.۱۷.Forones NM, Carvalho AP, Giannotti-Filho O, Lourenco LG, Oshima CT. Cell proliferation and apoptosis in gastric cancer and intestinal metaplasia. Arq Gastroenterol. ۲۰۰۵ Jan-Mar; ۴۲(۱): ۳۰-۴.۱۸.Kapadia CR. Gastric atrophy, metaplasia and dysplasia: a clinical perspective. J Clin Gastroenterol. ۲۰۰۳ May-Jun; ۳۶(۵ Suppl): S۲۹-۳۶.
۱۹.Sepulveda A, Peterson LE, Shelton J, Gutierrez O, Graham DY. Histological patterns of gastritis in H. pylori-infected individuals with a family history of gastric cancer. Am J Gastroenterol. ۲۰۰۲ Jun; ۹۷(۶): ۱۳۶۵-۷۰.
۲۰.Tsutsumi Y, Ohshita T, Yokoyama T. A case of gastric carcinoma with massive eosinophilia. Acta Pathol Jpn. ۱۹۸۴ Jan; ۳۴(۱): ۱۱۷-۲۲.
۲۱.Hong SW, Cho MY, Park C. Expression of eosinophil chemotactic factors in stomach cancer. Yonsei Med J. ۱۹۹۹ Apr; ۴۰(۲): ۱۳۱-۶.
۲۲.Iwasaki K, Torisu M, Fujimura T. Malignant tumor and eosinophils. I. Prognostic significance in gastric cancer. Cancer. ۱۹۸۶ Sep; ۵۸(۶): ۱۳۲۱-۷.
منابع:
۱.Pellicano R, Fagoonee S, Palestro G, Rizzetto M, Ponzetto A. Intestinal metaplasia, dysplasia, gastric cancer and Helicobacter pylori: epidemiological observations. Minerva Med. ۲۰۰۵ Feb; ۹۶(۱): ۱-۱۰.
۲.Devesa SS, Blot WJ, Fraumeni JF Jr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer. ۱۹۹۸ Nov; ۸۳(۱۰): ۲۰۴۹-۵۳.
۳.Noguchi Y, Yoshikawa T, Tsuburaya A. Is gastric carcinoma different between Japan and the United States? Cancer. ۲۰۰۰; ۸۹: ۲۲۳۷-۴۶.۴.You WC, Li JY, Zhang L, Jin ML, Chang YS, Ma JL, et al. Etiology and prevention of gastric cancer: a population study in a high-risk area of China. Chin J Dig Dis. ۲۰۰۵; ۶(۴): ۱۴۹-۵۴.۵. Mutoh H, Sakurai S, Satoh K, Tamada K, Kita H, Osawa H, et al. Development of gastric carcinoma from intestinal metaplasia in Cdx۲-transgenic mice. Cancer Res. ۲۰۰۴ Nov; ۶۴(۲۱): ۷۷۴۰-۷.
۶.Kato S, Nakajima S, Nishino Y, Ozawa K, Minoura T, Konno M, et al. Association between gastric atrophy and Helicobacter pylori infection in Japanese children: a retrospective multicenter study. Dig Dis Sci. ۲۰۰۶ Jan; ۵۱(۱): ۹۹-۱۰۴.۷.Pasechnikov VD, Chukov SZ. Kotelevets SM .Mostovov AN. Mernova VP. Possibility of non-invasive diagnosis of gastric mucosal precancerous changes. World J Gastroenterol. ۲۰۰۴ Nov; ۱۰(۲۱): ۳۱۴۶-۵۰.
۸.Fukuda S, Tanaka M, Soma Y. Histological analysis of gastritis and Helicobacter pylori infection in patients with early gastric cancer. J Gastroentral Hepatol. ۲۰۰۰; ۱۵(۱۲): ۱۳۷۰-۶.
۹.Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston ۱۹۹۴. Am J Surg Pathol. ۱۹۹۶ Oct; ۲۰(۱۰): ۱۱۶۱-۸۱
۱۰.Lauwers GY. Defining the pathologic diagnosis of metaplasia, atrophy, dysplasia and gastric adenocarcinoma. J Clin Gastroenterol. ۲۰۰۳ May-Jun; ۳۶(۵ Suppl): S۳۷-۴۳; discussion S۶۱-۲.
۱۱.Dinis-Ribeiro M, Lopes C, da Costa-Pereira A, Guilherme M, Barbosa J, Lomba-Viana H, et al. A follow up model for patients with atrophic chronic gastritis and intestinal metaplasia. J Clin Pathol. ۲۰۰۴ Feb; ۵۷(۲): ۱۷۷-۸۲.
۱۲.Zhang C, Yamada N, Wu YL, Wen M, Matsuhisa T, Matsukura N. Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cancer. World J Gastroenterol. ۲۰۰۵ Feb; ۱۱(۶): ۷۹۱-۶.
۱۳.Piscoya Rivera A, Bussaleu A, Cok J. Comparison of the histopathological finding among the biopsy of non cancerous gastric mucosa of patient with gastric cancer and the biopsy of gastric mucosa of dyspeptic patient without gastric cancer. Rev Castroenterol Peru. ۲۰۰۱; ۲۱(۲): ۱۰۷-۱۴.
۱۴.Oh JD, Kling-Backhed H, Giannakis M, Engstrand LG, Gordon JI. Interactions between gastric epithelial stem cells and Helicobacter pylori in the setting of chronic atrophic gastritis. Curr Opin Microbial. ۲۰۰۶ Feb; ۹(۱): ۲۱-۷.
۱۵.Ohata H, Kitauchi S, Yoshimura N, Mugitani K, Iwane M, Nakamura H, et al. Shimizu progression of chronic atrophic gastritis associated with Helicobacter pylori infection increases risk of gastric cancer. Int J Cancer. ۲۰۰۴ Mar; ۱۰۹(۱): ۱۳۸-۴۳.
۱۶.Leung WK, Ng EK, Chan WY, Auyeung AC, Chan KF, Lam CC, et al. Risk factors associated with the development of intestinal metaplasia in first-degree relatives of gastric cancer patients. Cancer Epidemiol Biomarkers Prev. ۲۰۰۵ Dec; ۱۴(۱۲): ۲۹۸۲-۶.۱۷.Forones NM, Carvalho AP, Giannotti-Filho O, Lourenco LG, Oshima CT. Cell proliferation and apoptosis in gastric cancer and intestinal metaplasia. Arq Gastroenterol. ۲۰۰۵ Jan-Mar; ۴۲(۱): ۳۰-۴.۱۸.Kapadia CR. Gastric atrophy, metaplasia and dysplasia: a clinical perspective. J Clin Gastroenterol. ۲۰۰۳ May-Jun; ۳۶(۵ Suppl): S۲۹-۳۶.
۱۹.Sepulveda A, Peterson LE, Shelton J, Gutierrez O, Graham DY. Histological patterns of gastritis in H. pylori-infected individuals with a family history of gastric cancer. Am J Gastroenterol. ۲۰۰۲ Jun; ۹۷(۶): ۱۳۶۵-۷۰.
۲۰.Tsutsumi Y, Ohshita T, Yokoyama T. A case of gastric carcinoma with massive eosinophilia. Acta Pathol Jpn. ۱۹۸۴ Jan; ۳۴(۱): ۱۱۷-۲۲.
۲۱.Hong SW, Cho MY, Park C. Expression of eosinophil chemotactic factors in stomach cancer. Yonsei Med J. ۱۹۹۹ Apr; ۴۰(۲): ۱۳۱-۶.
۲۲.Iwasaki K, Torisu M, Fujimura T. Malignant tumor and eosinophils. I. Prognostic significance in gastric cancer. Cancer. ۱۹۸۶ Sep; ۵۸(۶): ۱۳۲۱-۷.
منبع : مجله علمی پژوهشی دانشگاه علوم پزشکی شهر کرد
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
ایران مجلس دولت حجاب رئیس جمهور نماز جمعه رئیسی گشت ارشاد دولت سیزدهم کارگران رهبر انقلاب مجلس شورای اسلامی
سیل هواشناسی تهران کنکور شهرداری تهران سیستان و بلوچستان فضای مجازی سازمان سنجش قتل سلامت پلیس زنان
قیمت دلار قیمت طلا بازار خودرو خودرو قیمت خودرو دلار سایپا بانک مرکزی ارز مسکن ایران خودرو تورم
کیومرث پوراحمد پایتخت تلویزیون خانواده سینمای ایران سریال ترانه علیدوستی فیلم کتاب مهران مدیری موسیقی سینما
کنکور ۱۴۰۳ عبدالرسول پورعباس
اسرائیل رژیم صهیونیستی آمریکا فلسطین غزه جنگ غزه روسیه چین حماس اوکراین ترکیه ایالات متحده آمریکا
فوتبال پرسپولیس جام حذفی آلومینیوم اراک استقلال فوتسال بازی تراکتور تیم ملی فوتسال ایران باشگاه پرسپولیس بارسلونا باشگاه استقلال
هوش مصنوعی گوگل سامسونگ اپل فناوری ربات نخبگان همراه اول ناسا فیلترینگ
سازمان غذا و دارو کاهش وزن مالاریا آلزایمر زوال عقل