یکشنبه, ۹ اردیبهشت, ۱۴۰۳ / 28 April, 2024
مجله ویستا
سمیت کبدی عصاره آبی، متانولی و فراکسیون های عصاره متانولی گیاه سرخاب (Phytolacca americana) به روش پرفیوژن کبدی در موش صحرائی نر

گیاه سرخاب به خانواده فیتولاکاسه تعلق دارد. علفی، پایا، با ارتفاع حدود ۳ متر بومی شمال آمریکا (جنوب غربی کانادا و ایالت های ویرجینا فلوریدا ایالت متحده آمریکا) است و به فراوانی در سواحل دریای خزر می روید. برگهای این گیاه متناوب، بیضی شکل، بدون دندانه، فاقد تار با پهنک کامل بدون گوشوارک، با گل های سفید و یا سفید مایل به صورتی و میوه های به رنگ بنفش مایل به سیاه ارغوانی شبیه خوشه انگور می باشد . این گیاه اثرات متعدد درمانی در اختلالات گوارشی (ایجاد تهوع، استفراغ و اثر مسهلی)، روماتیسم مزمن و ضد میکروارگانیزمی (ضد میکروبی و ضد ویروسی) و کاهش آلودگی های قارچی و تحریک سیستم ایمنی دارد . در تحقیقات اخیر، وجود کدورت یا اختلالات کبدی گزارش شده است که برای اثبات فرضیه سمیت بافت کبدی به مطالعات تکمیلی نیاز است. دو تری ترپن ساپونینی فیتولاکتوکسین(Phytolactoxin) و فیتولاکسی ژنین (Phytolaccigenin) به عنوان عامل عمده سمیت شناسایی شدند. از طرفی میتوژن های گیاهی (PWM=Pokeweed mitogen) مانند Lectins به احتمال زیاد در سمیت کبدی دخالت دارند. توکسین ها و میتوژن های گیاهی روی سلول های پارانشیمال کبدی و یا به طور غیر مستقیم از طریق مواد میانجی آزاد شده از سلول های غیر پارانشیمال کبدی مثل کوپفر کبدی عمل می کنند و منجر تغییرات هیستو پاتولوژیک می شوند که اغلب در منطقه ۳ لوب کبدی مشاهده می شود . برای ارزیابی سمیت کبدی عوامل مختلفی از قبیل: بررسی تغییرات پروتئین تام، تغییرات آنزیماتیک (ALT/AST)، سنجش میزان ذخایر گلوتاتیون، ریز بینی نمونه ها و بررسی آسیب های بافتی قابل بررسی هستند. آنزیم های ترانس آمیناز هر چند اختصاصی نیستند ولـــی در بسیاری از آسیب های کبدی افزایش می یابند که ذخائر گلوتاتیون برای خنثی سازی متابولیت های الکتروفیل کفایت نمی کند و با
پراکسیداسیون غشاء چرب میتوکندری و لیزوزوم، آنزیم ها آزاد سازی می شوند.
اثرات سمی گیاه و فرایند سرطان زای آن کاربردهای متعدد و بهینه درمانی آن را با شک و تردید توأم می کند و نظارت و کنترل و محدود کردن مصرف آن را ضروری می نماید. به منظور ارزیابی سریع و نسبتاً دقیق میزان سمیت عصاره متانولی و عصاره آبی گیاه از سیستم پرفیوژن کبد جدا شده موش صحرایی که به حالت طبیعی و فیزیولوژیک شباهت زیادی دارد استفاده می شود. در این سیستم سلول های کبدی به طور مستقیم در مجاورت غلظت های مختلفی از عصاره متانولی و عصاره آبی گیاه قرار می گیرد. (اجزاء پلاسما و ارگان های مجاور و هورمون های موضعی روی سیستم پـــرفیوژن تأثیر چندانی ندارند) و در فاصله زمانی بسیار کوتاه مطالعه سمیت کبدی امکان پذیر می شود . با توجه به اینکه در خصوص سمیت کبدی گیاه سرخاب رشد یافته در شمال ایران مطالعه ای انجام نشده است. این مطالعه با هدف بررسی سمیت کبدی این گیاه با استفاده از سیستم پرفیوژن کبد جدا شده موش صحرایی که در مطالعات قبل استفاده شده است انجام شد.
● روش بررسی:
حیوانات: در این مطالعه تجربی از موش های صحرایی نر (رت) آلبینو از نژاد Sprague daweley با سنی حدود ۱۵-۱۰ هفته به وزن تقریبی ۲۲۰-۱۸۰ گرم استفاده شد. در سراسر مدت آزمایش موش ها تحت شرایط استاندارد و درجه حرارت مطلوب حدود ۲۲۱ درجه سانتی گـــراد و سیکل روشنایی/ تاریکی ۱۲ ساعته بـــه صورت گروههای شش تایی در قفس مخصوص حیوان آزمایشگاهی در حیوانخانه دانشکده داروسازی ساری نگهداری شدند. برای تغذیه آنها از غذای آماده فشرده شده و آب شهر استفاده شد.
عصاره گیری: ۱۲۰ گرم از سر شاخه های هوایی گلدار گیاه از سواحل دریای خزر استان مازندران جمع آوری و (از لحاظ جنس و گونه مورد تأیید متخصصین بخش گیاه شناسی دانشکده کشاورزی و منابع طبیعی ساری قرار گرفت) پس از آسیاب شدن و عبور از الک (مش ۱۰)، به روش پرکولاسیون با استفاده از متانول ۱۰۰ درصد و آب مقطر عصاره گیری شد. عمل عصاره گیری تا زمانی که عصاره خارج شده از پرکولاتور کاملاً بی رنگ شود، ادامه یافت که به ترتیب ۱۷/۱۶ درصد و ۱۷/۸ درصد بازده عصاره استخراجی متانولی و آبی بدست آمد. عصاره حاصله توسط دستگاه تقطیر در خلاء چرخان در حرارت ۳۰ درجه سانتی گراد تغلیظ و برای خشک شدن در آون ۳۰ درجه سانتی گراد قرار داده شد.
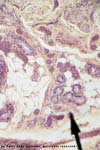
به منظور تهیه فراکسیون های مختلف عصاره متانولی از کروماتوگرافی ستونی با فاز ساکن سیلیکاژل و فازهای متحرک کلروفرم،اتیل استات و متانول استفاده شد. نحوه آماده سازی ستون به این ترتیب بود که سیلیکاژل را با مقداری مناسب از کلروفرم مخلوط کرده طوری که از سوی دیگر خارج شده و کاملاً سیلیکاژل ها روی هم فشرده (Pack) می گردد. عصاره متانولی را در متانول حل کرده و بعد از بهم زدن با سیلیکاژل و خشک شدن آن، عصاره به طور کامل به سیلیکاژل چسبید و در داخل ستون به سیلیکاژل های قبلی اضافه می شد. بعد دو مرتبه روی آن مقداری سیلیکاژل افزوده و مجدداً کلروفرم ریخته می شد. همیشه ستون پر از حلال بود، زیرا در صورت تبخیر حلال سیلیکاژل خشک و فشرده شده و باعث شکسته شدن ستون می گردید. شستشوی ستون را با کلروفرم ۱۰۰ درصد شروع کرده و با لکه گذاری در TLC (Thin layer chromatography) خروج مواد از ستون کنترل می گردید. پس از اطمینان از خروج کامل مواد محلول در کلروفرم، فاز متحرک را با اتیل استات جایگزین کرده و عملیات تکرار گردید و در پایان باقی مانده عصاره در ستون توسط متانول شستشو داده شد . به این ترتیب ۳ فراکسیون کلروفرمی، اتیل استاتی و متانولی با پلاریته های مختلف فراهم شد.موشها به ۲۱ گروه شش تایی تقسیم شدند. گروه اول: گروه شاهد بودند که فقط مایع پرفیوژن دریافت کردند. برای ۱۰ گروه بعد عصاره های آبی و متانولی با دوزهایmg/kg ۱۰۰، ۵۰، ۴۰، ۲۰، ۱۰ برای ۹ گروه دیگر از گروه های باقی مانده فراکسیون های کلروفرمی متانولی و اتیل استاتی با دوزهایmg/kg ۴۰، ۲۰، ۱۰ به مایع پرفیوژن اضافه شد . برای گروه آخر توئین ۸۰ (به منظور انحلال فراکسیون کلروفرمی و اتیل استاتی در مایع پرفیوژن) به مایع پرفیوژن اضافه شد.بعد از بی هوشی کامل حیوان مورد آزمایش توسط دی اتیل اتر، حفره شکمی حیوان (به صورت T شکل در راستای خط وسط شکم و دو سمت آن یعنی جناحین) باز گردید. روده و احشاء داخلی به یک طرف حفره شکمی منتقل شد. با استفاده از اسکالپ وین ریز (شماره ۲۳) به ورید باب دسترسی پیدا کرده و به جریان پرفیوژن وصل گردید. به فاصله کوتاهی در ورید اجوف تحتانی کانول مناسب (شماره ۲۱) وارد شده و بعد محکم گردید. بعد از برقراری جریان مایع پرفیوژن، عصاره های آبی و متانولی و فراکسیون های کلروفرمی متانولی و اتیل استاتی از عصاره متانولی گیاه به صورت یک محلول همگن به مایع پرفیوژن (۲/۷PH=) اضافه شد . مایعات خروجی از ورید اجوف تحتانی، در فاصله هر نیم ساعت به منظور اندازه گیری آنزیم هایALT وAST جمـع آوری و نمونه های بافت کبدی به منظور آزمایشات هیستوپاتولوژیکی در فرمالین ۱۰ درصد نگهداری شدند و شاخص های پاتولوژی مانند نکروز، فیبروز، سلولاریته، ادم و ... مورد بررسی قرار گرفت .
تغییرات آنزیم آسپارتات ترانس آمیناز یا گلوتامیک اکسالواستیک ترانس آمیناز(SGOT, AST) و آلانین ترانس آمیناز با آنزیم گلوتامیک پاپرُویک ترانس آمیناز (SGPT, ALT) موجود در مایعات بیولوژیک و سرم، با استفاده از پروتکل شرکت زیست شیمی انجام پذیرفت. اسیدهای حاصله از آنزیمهای فوق با معرف رنگزا به اسیدهای هیدرازون تبدیل میشود که بعد از اضافه کردن سود سوزآور، میزان جذب کدورت قهوه رنگ، بوسیله اسپکتوفتومتری در ۵۰۵ نانومتر قرائت شد و با استفاده از منحنی استاندارد غلظت آنزیمی اندازه گیری گردید.داده ها به روش آنالیز واریانس (ANOVA) و بدنبال آن Student- Newman Keuls´ test تجزیه و تحلیل گردید. اختلاف با ۰۵/۰p< از لحاظ آماری معنی دار تلقی شد.
● یافته ها:
فعالیت آنزیم های ALT و AST بین دوزهای استفاده شده عصاره آبی و متانولی گیاه سرخاب(mg/kg ۱۰،۲۰،۴۰،۵۰،۱۰۰) با گروه کنترل در تمام زمان های نمونه گیری (۳۰،۶۰،۹۰،۱۲۰،۱۵۰،۰ دقیقه) اختلاف معنی داری نشان می دهد (۰۰۱/۰p<). تغییرات آنزیمی ALT و AST بعد از گذشت ۶۰ دقیقه از پرفیوژن به حداکثر می رسد و بعد سیر نزولی پیدا می کند (نمودار شماره ۱ و ۲).
در پرفیوژن فراکسیون کلروفرمی و اتیل استاتی با دوز mg/kg ۱۰ در فاصله زمانی ۶۰ دقیقه سطح آنزیم ALT نسبت به گروه کنترل تغییر نکرد، در حالی که فراکسیون متانولی با دوزهای mg/kg ۱۰،۲۰،۴۰ و همین طور فراکسیون کلروفرمی و اتیل استاتی با دوزmg/kg ۴۰ و۲۰ در تمام زمان های نمونه گیری سبب افزایش سطح آنزیم ALT نسبت به گروه کنترل شد (۰۵/۰p<). همچنین فراکسیون کلروفرمی و اتیل استاتی در دوز mg/kg ۱۰ در زمان های ۱۲۰ و ۱۵۰ دقیقه سطح آنزیم ALT کاهش یافت (۰۵/۰p<) (نمودار شماره ۳). در نمونه های مایع پرفیوژن حاوی فراکسیون کلروفرمی و اتیل استاتی با دوز mg/kg ۱۰ تا فاصله زمانی ۶۰ دقیقه سطح آنزیم AST افزایش نیافته است، در حالی که فراکسیون متانولی با دوزهای mg/kg ۱۰،۲۰،۴۰ و فراکسیون کلروفرمی و اتیل استاتی با دوزهای mg/kg ۲۰ و ۴۰، در تمام زمان های نمونه گیری موجب تغییرات قابل توجه در سطح آنزیم AST نسبت به گروه کنترل شد (۰۵/۰p<). با این وجود در نمونه های پرفیوژن شده فراکسیون کلروفرمی و اتیل استاتی با دوز mg/kg ۱۰ در زمان ۹۰ دقیقه سطح آنزیم AST تنزل یافته و دوباره در زمان های ۱۵۰ و ۱۲۰ دقیقه سطح آنزیم AST افزایش می یابد (۰۵/۰p<) (نمودار شماره ۴).
فراکسیون متانولی با دوزهای mg/kg ۲۰،۴۰،۱۰ و فراکسیون کلروفرمی و اتیل استاتی بـا دوزهایmg/kg ۲۰،۴۰ نسبت به فراکسیون اتیل استــــاتی و کلروفــــرمی با دوز mg/kg ۱۰ نقش بیشتری در ایجاد سمیت کبدی دارند. بالا رفتن دوز در فراکسیون کلروفرمی و اتیل استاتی سبب ایجاد سمیت کبدی در تمام زمان های نمونه گیری شد.نتایج هیستوپاتولوژی نشان داد که تعداد سلول های کوپفر کبدی افزایش یافتند و با انفیلترای بافت کبد همراه بودند.
نمودار شماره ۱: فعالیت آنزیم های آلانین ترانس آمیناز و آسپارتات ترانس آمیناز در دوزهای مختلف عصاره متانولی گیاه سرخاب در زمانهای مختلف
ALT: آلانین ترانس آمیناز
AST: آسپارتات ترانس آمیناز
۰۰۱/۰p< در تمام زمانها و در کلیه دوز ها نسبت به گروه کنترل.
دوزها بر اساس mg/kg می باشد.
نمودار شماره ۲: فعالیت آنزیم های آلانین ترانس آمیناز و آسپارتات ترانس آمیناز در دوزهای مختلف عصاره آبی گیاه سرخاب در زمانهای مختلف
ALT: آلانین ترانس آمیناز
AST: آسپارتات ترانس آمیناز
۰۰۱/۰p< در تمام زمانها و کلیه دوزها نسبت به گروه کنترل.
دوزها بر اساس mg/kg می باشد.
نمودار شماره ۳: فعالیت آنزیم آلانین آمیناز در گروههای مختلف فراکسیون های گیاه سرخاب در زمانهای مختلف
ALT : آلانین ترانس آمیناز
CH.F : فراکسیون کلروفرمی
ET.F : فراکسیون اتیل استاتی
ME.F : فراکسیون متانولی
۰۵/۰p< در کلیه گروهها به جز دوز mg/kg ۱۰ فراکسیون کلروفرمی و اتیل استاتی و همه زمانها نسبت به گروه کنترل.
دوزها بر اساس mg/kg می باشد.
نمودار شماره ۴: فعالیت آنزیم آسپارتات ترانس آمیناز در دوزهای مختلف فراکسیون های گیاه سرخاب در زمانهای مختلف
AST : آسپارتات ترانس آمیناز
CH.F : فراکسیون کلروفرمی
ET.F : فراکسیون اتیل استاتی
ME.F : فراکسیون متانولی
۰۵/۰p< در کلیه گروهها جز دوز mg/kg ۱۰ فراکسیون کلروفرمی و اتیل استاتی و همه زمانها نسبت به گروه کنترل.
دوزها بر اساس mg/kg می باشد.
● بحث:
این تحقیق به عنوان اولین تحقیق در مورد اثر سمیت کبدی گیاه فیتولاکاامریکانا با روش پرفیوژن کبدی می باشد که در آن نمونه برداری از مایعات شبه بیولوژیک در طی پرفیوژن به دو طریق انجام می شود و هر نمونه برای یکسری از پاسخ ها مناسب می باشد. ساپونین های تری ترپنوئیدی نظیر فیتولاکسین (Phytolaccine) و فیتولاکسی ژنین (Phytolaccigenin) و میتوژن های گیاهی مثل PWM (Pokeweed mitogen) توکسین های شناخته شده ای هستند که منجر به خصوصیات تحریک پذیری و میتوژنیک می شوند . فیتولاکسین در تمام قسمت های گیاه وجود دارد و در آب، الکل و کلروفرم قابل حلال است. بر اثر هیدرولیز این عامل سمی موادی مانند ساپوژنین سلولز، گالاکتوز و دکستروز تولید می شود .
PWM یک میتوژن گیاهی است که با مکانیسمی ناشناخته بیوترانسفورماسیون P۴۵۰ را متوقف می کند که ممکن است به طور مستقیم بر روی سلول های پارانشیمال کبدی و یا به طور غیر مستقیم از طریق مواد میانجی آزاد شده سلول های کوپفر و ماکروفاژهای کبدی باشد که منبع مهم سیتوکین ها می باشند و سبب ایجاد گونه های اکسیژن فعال، NO، TNF، IL۶، GM-CSF و IL۱ می شود .مطالعات دیگری نشان می دهد کهPWM دارای اثر میتوژنیک بر روی لنفوسیت های &#۹۴۶; می باشد که باعث القاء تولید ایمونو- گلوبولین ها از لنفوسیت های &#۹۴۶; می شود که منجر به کاهش واکنش منواکسیژناز وابسته به P۴۵۰ میکروزمال کبدی می شود .پروتئین ضد ویروسیPokeweed (PAP) و بعضی از محرک های ایمنی مانند ویروس ها، القاء کننده های اینترفرون، اندوتوکسین های باکتریایی و سیتوکین های التهابی به عنوان عامل غیر فعال کننده ریبوزوم (Ribosome Inactive Protein=RIP) محسوب می شوند که از اتصال فاکتور طویل شدن EF۲(Elongation factor) به ریبوزوم جلوگیری می کند. بنابراین متابولیسم وابسته به سیتوکرومP۴۵۰ متوقف می شود .
سوسپانسیون نمکی عصاره الکلی ریشه و میوه سرخاب خیلی محرک هستند و تزریق داخل صفاقی آنها برای رت و خوکچه هندی میزان مرگ و میر بالایی را در پی دارد. تزریق وریدی به گربه های بیهوش شده باعث سرکوب سیستم تنفسی و گردش خون می شود. هنگامی که عصاره رقیق ریشه گیاه از طریق لوله به درون معده گربه تخلیه شود، باعث استفراغ شدید می گردد. تجویز خوراکی مقادیر زیاد عصاره سیال آسیب جدی به فرآیند فیزیولوژیک کلیوی خرگوش ها وارد نمی کند، ولی بافت کبد مصون نمی ماند . گزارش شده است که در اثر تجویز فیتولاکاژنین (Phytolaccagenin) به صورت تزریق داخل صفاقی با حداکثر دوز g/kg ۲ مرگی در رت ها مشاهده نشده است. همچنین دوزهای خوراکی از ساپونین ها تا حداکثر g/kg ۵/۱ هیچ مرگ و میری در رت ها به دنبال نداشته است . در پی تجویز داخل صفاقی عصاره آب- الکلی ریشه گیاه به گربه با دوزی معادل g/kg ۱ به ازاء هر کیلوگرم وزن بدن حیوان به ترتیب ناراحتی، تهوع و گاهی استفراغ، کاهش تدریجی استفاده از پاهای عقبی و جلویی، خواب آلودگی و کاهش احساس درد، ضربان قلب آهسته و ضعیف تر و تنفس کم عمق تر و در نهایت مرگ در اثر نارسایی تنفسی مشاهده شده است . سمیت ساپونین استروئیدی اسیدی که از ریشه P.americana به دست آمده بود را روی موش ها آزمایش شد که LD۵۰ داخل صفاقی آن mg/kg ۰۶۵/۰ برآورد گردیده است. دوزهای کشنده این ماده فعالیت تضعیفی مشخصی به ویژه روی گردش خون و تنفس داشته و در مقادیر به نسبت زیادتر، موجب تشنج شدید شده است . بررسی های آزمایشگاهی روی سمیت میوه سرخاب کولی در پرندگان خانگی نتایج متناقضی داشت. در یک بررسی، تغذیه میوه گیاه در تعدادی جوجه و یک اردک بی ضرر بوده است . در حالی که در یک بررسی دیگر، تجویز میوه به جوجه بوقلمون باعث کاهش سرعت رشد، آتاکسی، ناتوانی در راه رفتن و در نهایت موجب مرگ شد . بدین ترتیب ساپونین های تری ترپنوئیدی مانند فیتولاکسین، فیتولاکسیژنین، ایمنوتوکسین های PAP، میتوژن های گیاهی PWM و یا آلکالوئید های گیاهی و مواد هیستامینیکی در بروز سمیت عمومی و سمیت اختصاصی کبد نقش به سزایی دارند. در زمان ۶۰ دقیقه نمونه گیری، تغییرات آنزیم ها در گروه های مورد آزمایش بیشترین اختلاف را با گروه کنترل دارد (۰۰۱/۰p<). این سیر افزایشی آنزیم های ترانس آمیناز با روند کاهشی گلوتاتیون (GSH) همراه است. وقتی که ذخائرGSH برای خنثی سازی متابولیت الکتروفیل کفایت نمی کند ولی تصور می شود عوامل محافظت کننده ها بویژه گلوتاتیون بعــد از ۴۵ الی ۶۰ دقیقـــه احیا
می شود. در دوزهای بالا (mg/kg ۱۰،۲۰) فراکسیون های کلروفرمی و اتیل استاتی سلول های کوپفر کبدی افزایش یافته است که مبین آزردگی و آسیب بافت کبد می باشد. برای شناخت مکانیسم اثر سمیت کبدی این گیاه به تحقیقات بیشتر و گسترده تر نیازمند است و با انجام مطالعات تکمیلی روند ادامه تحقیقات در جهت کاربردی نمودن نتایج را تسهیل کرد.
● نتیجه گیری:
یافته ها نشان داد که گیاه سرخاب گیاهی با قابلیت ایجاد سمیت کبدی وابسته به دوز می باشد. لذا کاهش دوز مصرفی می تواند در پیشگیری از عوارض جانبی کبدی مد نظر قرار گیرد.
دکتر محمد کرمی، دکتر نقی شهابی مجد، دکتر سودابه سعیدنیا، ندا عمرانی استادیار گروه فارماکولوژی و سم شناسی -دانشگاه علوم پزشکی مازندران، استادیار گروه فیزیولوژی و فارماکولوژی- دانشگاه علوم پزشکی مازندران، استادیار گروه فارماکوگنوزی، مرکز تحقیقات گیاهان دارویی - دانشگاه علوم پزشکی تهران، دانشجوی دکتری داروسازی – دانشگاه علوم پزشکی مازندران
منابع:
۱.زرگری علی. گیاهان داروئی. جلد چهارم، چاپ پنجم، انتشارات دانشگاه تهران. ۱۳۷۳، ۲۰۸.۲.شهابی مجد نقی. بررسی فیتوشیمی گیاهان منطقه ساری، پایان نامه جهت اخذ دکتری داروسازی. دانشگاه علوم پزشکی، دانشکده داروسازی مشهد. ۱۳۶۸، ۳۰-۱۱۸، ۹۵-۱۸۵.۳.Newall C. Herbal medicine: a guide for health-care professional. London: Pharmaceutical Press. KDP; ۱st ed. ۱۹۹۶. p: ۲۱۵-۱۹.
۴.Escalante MA, Santecchia CB. Species in critic risk. J Ethnopharmacol. ۲۰۰۲; ۸۲(۱): ۲۹-۳۴.
۵.Macht DI. A pharmacological study of Phytolacca americana. J Am Pharm Assoc Sci. ۱۹۳۷; ۲۶: ۵۹۴-۹.
۶.Tyler VE. The new honest herbal. In: George F. A sensible guide to herbs and related remedies. Philadelphia: Stickley Company. ۲nd ed. ۱۹۸۷; ۱۸۲-۳.
۷.Walter HL, Memory PF. Medical botany, plants affecting man’s health. NewYork: Willey Interscience. ۱۹۷۷; p: ۵۸۷.
۸.Woo WS, Kang SS. Phytolaccoside B: triterpene glycoside from Phytolacca Americana. Photochemistry. ۱۹۷۶; ۱۵: ۱۳۱۵-۱۷.۹.Woo WS, Shin KH. Anti-inflammatory action of Phytolacca americana saponin. J Pharm Sco Korea. ۱۹۷۶; ۲۰: ۱۴۹-۵۵.۱۰. Hendrickson JM, Hilbert KF. Pokeweed berries not poisonous for chickens. J Am Vet Med Assoc. ۱۹۳۱; ۷۸: ۵۵۶-۸.۱۱.Kurinov IV, Uckum FM. High resolution X-ray structure of potent anti-HIV pokeweed antiviral protein-III. Biochem Pharmacol. ۲۰۰۳; ۶۵(۱۰): ۱۷۰۹-۱۱.
۱۲.Reinhold D, Bank U, Buhling F, Lendecked U. Transforming growth factor-beta I (TGF-beta ۱) inhibits DNA synthesis of PWM stimulated PBMC via suppression of IL-۲ and IL-۶ production. Cytokine. ۱۹۹۴; ۶: ۳۸۲-۸.
۱۳.Lewis WH, Smith PR. Pokeroot herbal tea poisoning. JAMA. ۱۹۷۹; ۴۲: ۲۷۵۹-۶۰.
۱۴.صمصام شریعت. عصاره گیری و استخراج مواد مؤثره گیاهان دارویی. تهران: انتشارات مانی. ۱۳۷۷، ۱۶-۸، ۱۸۷.۱۵.Goldestein SW, Jenkins GL, Thompson MR. A chemical and pharmacological study Phytolacca americana. J Am Pharm Assoc. ۱۹۷۳; ۲۶: ۳۰۶-۱۲.
۱۶.Ahmed ZF, Zufall CJ, Jenkins GL. A contribution to the chemistry and toxicology of the root of Phytolacca americana L. J Am Pharm Assoc. ۱۹۴۹; ۳۸: ۴۴۳-۸.
۱۷.Wolkoff AW. The isolated perfused rat liver, preparation and application. Anal Biochem. ۱۹۸۷; ۱۶۷: ۱-۱۴.
۱۸.Ghazi-Khansari M, Karami M, Rezayat M, Minaei B, Abdollahi M, Sabzevari O. The protective effects of anti-oxidants and propranolol on hepatotoxicity of TCDD during isolated rat liver perfusion. Int J Pharmacol. ۲۰۰۵; ۱(۴): ۳۳۶-۴۱.
۱۹.Karami M. Histopathological study of TCDD by isolated rat liver perfusion system. Med J Islamic Republic Iran. ۲۰۰۱; ۱۵(۱): ۵۵-۶۰.۲۰.Jeong HG, Lee SS, Kim HK, Yang HH. Murine cyplal induction in mouse hepatoma hepa-lclc۷ cells by myristicin. Biochem Biophys Res Commun. ۱۹۹۷; ۲۳۳: ۶۱۹-۲۲.
۲۱.Maddaida VT. Gluthation correlated with lipid peroxidation in liver mitochondria of triiodothyronine- injected hypophysectomized rats. FASEB J. ۱۹۹۰; ۴: ۱۵۱۳-۱۸.
۲۲.Kew MC. Serum aminotransferase concentration as evidence of hepatocellular damage. Lancet. ۲۰۰۰; ۳۵۵: ۵۹۱-.
۲۳.Xiamei Z, Zhong H. Preparation of the antiviral protein from pokeweed seeds and assay of its toxicity. Acta Bot Yunnanica. ۱۹۸۹; ۱۱: ۴۴۰-۴۸.
۲۴.Wallays G, Ceuppens JL, Human T. lymphocyte activation by pokeweed mitogen induces production of TNF-alpha and GM-CSF and helper signaling by IL-۱ and IL-۶ result in IL-۲-dependent T cell growth. Eur Cytokine Netw. ۱۹۹۳; ۴: ۲۶۹-۷۷.۲۵.Decker K. The response of liver macrophages to inflammatory stimulation. Kieo J Med. ۱۹۹۸; ۴۷: ۱-۹.
۲۶.Barnett BD. Toxicity of pokeberries (fruit of Phytolacca americana large) for turkey poults. Poultry Sci. ۱۹۷۵; ۵۴: ۱۲۱۵-۱۷
منابع:
۱.زرگری علی. گیاهان داروئی. جلد چهارم، چاپ پنجم، انتشارات دانشگاه تهران. ۱۳۷۳، ۲۰۸.۲.شهابی مجد نقی. بررسی فیتوشیمی گیاهان منطقه ساری، پایان نامه جهت اخذ دکتری داروسازی. دانشگاه علوم پزشکی، دانشکده داروسازی مشهد. ۱۳۶۸، ۳۰-۱۱۸، ۹۵-۱۸۵.۳.Newall C. Herbal medicine: a guide for health-care professional. London: Pharmaceutical Press. KDP; ۱st ed. ۱۹۹۶. p: ۲۱۵-۱۹.
۴.Escalante MA, Santecchia CB. Species in critic risk. J Ethnopharmacol. ۲۰۰۲; ۸۲(۱): ۲۹-۳۴.
۵.Macht DI. A pharmacological study of Phytolacca americana. J Am Pharm Assoc Sci. ۱۹۳۷; ۲۶: ۵۹۴-۹.
۶.Tyler VE. The new honest herbal. In: George F. A sensible guide to herbs and related remedies. Philadelphia: Stickley Company. ۲nd ed. ۱۹۸۷; ۱۸۲-۳.
۷.Walter HL, Memory PF. Medical botany, plants affecting man’s health. NewYork: Willey Interscience. ۱۹۷۷; p: ۵۸۷.
۸.Woo WS, Kang SS. Phytolaccoside B: triterpene glycoside from Phytolacca Americana. Photochemistry. ۱۹۷۶; ۱۵: ۱۳۱۵-۱۷.۹.Woo WS, Shin KH. Anti-inflammatory action of Phytolacca americana saponin. J Pharm Sco Korea. ۱۹۷۶; ۲۰: ۱۴۹-۵۵.۱۰. Hendrickson JM, Hilbert KF. Pokeweed berries not poisonous for chickens. J Am Vet Med Assoc. ۱۹۳۱; ۷۸: ۵۵۶-۸.۱۱.Kurinov IV, Uckum FM. High resolution X-ray structure of potent anti-HIV pokeweed antiviral protein-III. Biochem Pharmacol. ۲۰۰۳; ۶۵(۱۰): ۱۷۰۹-۱۱.
۱۲.Reinhold D, Bank U, Buhling F, Lendecked U. Transforming growth factor-beta I (TGF-beta ۱) inhibits DNA synthesis of PWM stimulated PBMC via suppression of IL-۲ and IL-۶ production. Cytokine. ۱۹۹۴; ۶: ۳۸۲-۸.
۱۳.Lewis WH, Smith PR. Pokeroot herbal tea poisoning. JAMA. ۱۹۷۹; ۴۲: ۲۷۵۹-۶۰.
۱۴.صمصام شریعت. عصاره گیری و استخراج مواد مؤثره گیاهان دارویی. تهران: انتشارات مانی. ۱۳۷۷، ۱۶-۸، ۱۸۷.۱۵.Goldestein SW, Jenkins GL, Thompson MR. A chemical and pharmacological study Phytolacca americana. J Am Pharm Assoc. ۱۹۷۳; ۲۶: ۳۰۶-۱۲.
۱۶.Ahmed ZF, Zufall CJ, Jenkins GL. A contribution to the chemistry and toxicology of the root of Phytolacca americana L. J Am Pharm Assoc. ۱۹۴۹; ۳۸: ۴۴۳-۸.
۱۷.Wolkoff AW. The isolated perfused rat liver, preparation and application. Anal Biochem. ۱۹۸۷; ۱۶۷: ۱-۱۴.
۱۸.Ghazi-Khansari M, Karami M, Rezayat M, Minaei B, Abdollahi M, Sabzevari O. The protective effects of anti-oxidants and propranolol on hepatotoxicity of TCDD during isolated rat liver perfusion. Int J Pharmacol. ۲۰۰۵; ۱(۴): ۳۳۶-۴۱.
۱۹.Karami M. Histopathological study of TCDD by isolated rat liver perfusion system. Med J Islamic Republic Iran. ۲۰۰۱; ۱۵(۱): ۵۵-۶۰.۲۰.Jeong HG, Lee SS, Kim HK, Yang HH. Murine cyplal induction in mouse hepatoma hepa-lclc۷ cells by myristicin. Biochem Biophys Res Commun. ۱۹۹۷; ۲۳۳: ۶۱۹-۲۲.
۲۱.Maddaida VT. Gluthation correlated with lipid peroxidation in liver mitochondria of triiodothyronine- injected hypophysectomized rats. FASEB J. ۱۹۹۰; ۴: ۱۵۱۳-۱۸.
۲۲.Kew MC. Serum aminotransferase concentration as evidence of hepatocellular damage. Lancet. ۲۰۰۰; ۳۵۵: ۵۹۱-.
۲۳.Xiamei Z, Zhong H. Preparation of the antiviral protein from pokeweed seeds and assay of its toxicity. Acta Bot Yunnanica. ۱۹۸۹; ۱۱: ۴۴۰-۴۸.
۲۴.Wallays G, Ceuppens JL, Human T. lymphocyte activation by pokeweed mitogen induces production of TNF-alpha and GM-CSF and helper signaling by IL-۱ and IL-۶ result in IL-۲-dependent T cell growth. Eur Cytokine Netw. ۱۹۹۳; ۴: ۲۶۹-۷۷.۲۵.Decker K. The response of liver macrophages to inflammatory stimulation. Kieo J Med. ۱۹۹۸; ۴۷: ۱-۹.
۲۶.Barnett BD. Toxicity of pokeberries (fruit of Phytolacca americana large) for turkey poults. Poultry Sci. ۱۹۷۵; ۵۴: ۱۲۱۵-۱۷
منبع : مجله علمی پژوهشی دانشگاه علوم پزشکی شهر کرد
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
مجلس مجلس شورای اسلامی ایران حجاب شورای نگهبان دولت سیزدهم دولت جمهوری اسلامی ایران جنگ رئیسی گشت ارشاد رئیس جمهور
هواشناسی تهران تصادف پلیس شهرداری تهران دستگیری سیل قتل وزارت بهداشت کنکور سلامت سازمان هواشناسی
قیمت دلار مالیات قیمت خودرو خودرو بانک مرکزی دلار بازار خودرو قیمت طلا سایپا مسکن ارز ایران خودرو
زنان وزارت فرهنگ و ارشاد اسلامی محمدرضا گلزار سریال سینمای ایران تلویزیون سینما سریال پایتخت موسیقی فیلم ترانه علیدوستی قرآن کریم
کنکور ۱۴۰۳ خورشید
اسرائیل رژیم صهیونیستی فلسطین غزه آمریکا جنگ غزه روسیه چین اوکراین حماس عربستان ترکیه
فوتبال پرسپولیس استقلال فوتسال بازی سپاهان جام حذفی آلومینیوم اراک تیم ملی فوتسال ایران تراکتور باشگاه پرسپولیس بارسلونا
تبلیغات اپل ایرانسل فناوری سامسونگ ناسا آیفون بنیاد ملی نخبگان ربات
سرطان خواب بارداری دندانپزشکی مالاریا