چهارشنبه, ۱۲ اردیبهشت, ۱۴۰۳ / 1 May, 2024
مجله ویستا
ماهیت پیوند در فلزات -اجسام نا رسانا
۲) اجسام نارسانا
● ماهیت پیوند در فلزات :
خواص ویژه فلزها ( خواص فیزیکی و مکانیکی ) و اعداد کوئوردیناسیون نسبتاً بالای شبکه بلور فلزها (یعنی پیوند هر اتم فلز با تعداد ۸ تا ۱۲ اتم دیگر) ، نشان می دهد که پیوند بین اتم های فلز در شبکه بلور با سایر پیوندهای شیمیایی (مثلاً پیوند یونی یا کوالانسی) تقاوت دارد . پیوند در شبکه بلور فلزی نمی تواند از نوع یونی باشد ، زیرا :
- تمام ذرات در شبکه بلور فلزی یکسان اند و تفاوتی از نظر الکترون خواهی با یکدیگر ندارند .
- فلزها در حالت جامد ( بر خلاف مواد یونی ) و هم در حالت مذاب جریان برق را از خود عبور می دهند و ضمن عبور جریان برق از خود تجزیه نمی شود .
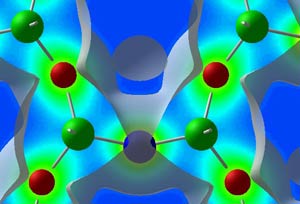
بین اتم های فلز در شبکه بلور ، پیوند ویژه ای وجود دارد ، که اصطلاحاً پیوند فلزی نامیده می شود . در توجیه این نوع پیوند و چگونگی اتصال ذرات فلزی در شبکه فلزی ، باید توجه داشت که انرژی یونیزاسیون فلزها نسبت به غیر فلزها ، نسبتاً کمتر و تعداد اوربیتال های خالی ظرفیت اتم آنها نسبت به تعداد الکترون های لایه ظرفیت نیز کم است . از این رو ، تعدادی از الکترون های سست لایه ظرفیت اتم فلز ، تا حدی از قید جاذبه هسته رها شده و بدون اینکه تحت تاثیر جاذبه هسته معینی قرار داشته باشد ، در اوربیتال های خالی لایه ظرفیت در فضاهای خالی بین اتم های فلز پراکنده شده ، دارای آزادی حرکت می باشند .
در هر دوره از عناصر ، با افزایش تعداد الکترون های لایه ظرفیت ، ابتدا انرژی پیوندی به تدریج افزایش یافته و سپس در عناصر آخر سری کاهش می یابد . دلیل افزایش انرژی پیوند در عناصر اول سری با زیاد شدن تعداد الکترونهای جفت نشده در تراز d، کاهش شعاع اتمی و امکان تشکیل تعداد بیشتری از پیوندهای فلزی – فلز است . چون تعداد این الکترون ها در عناصر میانی سری به حداکثر (تا شش الکترون در کروم و تنگستن ) می رسد و شعاع نیز در حداقل ممکن می رسد ، انرژی پیوستگی این فلز ها با بالاترین مقدار ممکن می رسد و این مقدار در مورد تنگستن در گروه VIB در دوره ششم ، به دلیل دخالت اثر انقباض لانتانیدی (کاهش شدید شعاع اتمی ) چشمگیرتر از عناصر دیگر واسطه است .
بر اساس نظریه گریفیت ، بالاترین تعداد پیوند کوالانسی به ازای هر اتم فلز برابر شش است که از طریق همپوشانی شش اوربیتال تک الکترونی ( پنج اوربیتال dو یک اوربیتال s) لایه ظرفیت فلز بر قرار می شود هر گاه اوربیتال های d لایه ظرفیت اتم فلز کاملاً پر شده باشند بالاترین تعداد پیوند کووالانسی به ازای اتم ممکن است به ۴ برسد که به شرکت اوربیتال های تک الکترونی لایه ظرفیت مربوط است .
بر اساس این نظریه ، روند تغییرات سایر خواص فلزها را نیز می توان به راحتی توجیه کرد . اصولاً اوربیتال های d و s در انرژی پیوستگی بلور فلزهای دوره های بالاتر نقش مهم و اوربیتال های sوp در این مورد ، اهمیت کمتری دارد . بدیهی است که بر این اساس ، خواص مغناطیسی و رسانایی فلزها را نمی توان توجیه کرد . پاولینگ برای توجیه خواص مغناطیسی و رسانایی فلزها چنین نظر دارد که از بین ۹ اوربیتال لایه ظرفیت اتم فلز حداکثر شش اوربیتال می تواند در تشکیل پیوند کووالانسی شرکت کند .
روند تغییر اندازه شعاع ها در مورد فلزهای واسطه هر دوره بر خلاف روند عادی آن در مورد تغییر انداز شعاع عناصر اصلی در دوره ها است . مثلاً در دوره چهارم ، اندازه شعاع فلزی در آغاز دوره با اسکاندیم شروع می شود و به تدریج کاهش می یابد و کمترین مقدار خود در آهن می رسد و از آن پس درباره رو به افزایش می گذارد . دلیل این روند به ظاهر غیر عادی روشن است ، زیرا چون اثر پوششی تراز ۳d بسیار ناچیز است در آغاز وارد شدن الکترون در آن ، مقداری که بر بار موثر هسته اتم افزوده می شود ، در مقابل مقداری که بر اثر پوششی و دافعه الکترون ها افزوده می شود ، فزونی دارد . در نتیجه بر اثر افزوده شدن تدریجی جاذبه هسته بر لایه خارجی ، اندازه شعاع نیز به تدریج کاهش می یابد تا اینکه به یک جداقل (در آهن ) می رسد . اما از آن پس ، بر اثر زیاد شدن تدریجی تعداد الکترون ها و پر شدن نسبی تراز ۳d دانسیته ابر الکترونی و در پی آن ، مقدار دافعه بین الکترون ها افزونی می یابد و به تدریج به میزان غلبه نیروهای دافعه بین الکترون ها بر نیروی جاذبه هسته بر الکترون های لایه خارجی افزوده می شود . از این رو اندازه اتم از آهن تا روی به تدریج افزایش می یابد . قابل توجه است که این تاثیر حتی در عنصر های اصلی گروه چهارم که بلافاصله پس از فلزهای واسطه دسته ۳d قرار دارند ، به چشم می خورد .
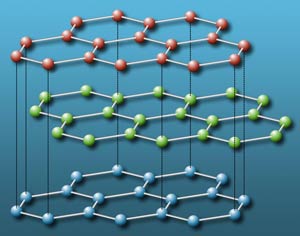
● اجـسـام نـارسانـا :
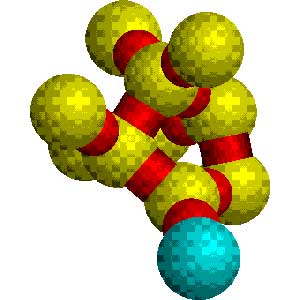
بر اساس نظریه باند ترازهای انرژی ، چنانچه در جسمی باند های تراز انرژی با هم همپوشانی نداشته باشند و بین آنها فاصله انرژی باند غیر مجاز یا شکاف انرژی نسبتا زیادی وجود داشته باشد ،عمل رسانایی الکتریکی به وسیله آن جسم صورت نخواهد گرفت .از این رو این اجسام را نارسانا می نامند .افزایش مواد خاصی به برخی از بلورها ،آثار رسانش درآنها ایجاد می کند .سیلیسیم و ژرمانیم خالص به طور ذاتی نیم رسانا هستند .این هردو عنصر در شبکه ای از نوع شبکه الماسی متبلور می شود که درآن هر اتم به چهار اتم دیگر متصل می شود .رسانایی ویژه سیلیسیم و ژرمانیم در دمای معمولی بسیار کم است ،زیرا الکترونها در پیوند های بلور درگیرند ولی دردماهای بالاتر به علت آنکه پیوند بلور شروع به گسستن می کند ، الکترونها آزاد شده ومیتوانند درداخل بلوربه حرکت درآیند بر اثر این پدیده رسانایی ویژه بلور افزایش می یابد.
افزایش مقادیر بسیار جزئی از بعضی ناخالصی ها به سیلیسیم و ژرمانیم سبب رسانایی ویژه آنها می شود .آنچه را که از این عمل حاصل می شودنیم رسانای عارضی می نامندمثلا با افزایش بور به سیلیسیم خالص رسانایی ویژه سیلیسیم تقریبا صدهزاربار افزایش می یابد.هر اتم Siچهار الکترون والانس دارد که در پیوند شبکه بلور آن شرکت می کنند .ولی هر اتم بور فقط سه الکترون والانس دارد . بنابر این هر اتم B که جای یک اتم Si را در بلور اشغال می کند تنها می تواند سه پیوند از چهار پیوند لازم برای شبکه کامل بلور را تشکیل دهند لذا جای خالی (یا حفره) الکترونی اشغال می شود . با انتقال الکترونی از یک پیوند مجاور به این حفره چهار پیوند اتم B تکمیل می شود ولی در عوض محل اصلی این الکترون خالی می ماند . بدین ترتیب الکترون ها در ساختمان بلور حرکت می کنند و حفره ها در خلاف جهت الکترون رسانایی جابجا می شوند . این نوع از نیم رسانای عارضی که در آن حفره ها سبب حرکت الکترون می شوند ، نیم رسانای نوع p نامیده می شود . p نشانه مثبت بودن است . البته این عبارت تا حدی گمراه کننده است ، زیرا بلور که کاملاً از اتم های خنثی تشکیل شده است ، از نظر الکتریکی خنثی می باشد .
کمبود الکترون در ساختمان بلور تنها از نظر پیوند کوالانسی شبکه است و بلور به هیچ وجه بار مثبت اضافی ندارد .
نیم رسانایی را ازنوع p می توان علاوه بر بور با افزایش مقادیر جزعی از سایر عناصر گروه IIIA (In,Ga,Al)به سیلیسیم یا ژرمانیم خالص نیز به دست آورد .ناخالصی هایی که تاثیرشان ناشی از توانایی الکترون پذیری آنها از طریق حفره هایی است که خود در شبکه بلور ایجاد می کنند ، ناخالصی های پذیرنده نامیده می شوند .
با افزایش مقادیر جزئی از هریک هریک از عناصر گروه (p-As-sb-Bi) vAبه سیلیسیم یا ژرمانیم نوع دیگری از نیم رسانای عارضی تولید می شود که به نیم رسانای نوعnمعروف اند.n،نشانه منفی بودن است .در این حالت هر اتم ناخالصی دارای پنج الکترون والانس، یعنی یک الکترون بیش ازتعداد لازم برای پیوند با بلور میزبان است .این الکترون اضافی میتوانددر ساختمان بلور به حرکت درآمده وبه عنوان الکترون رسانش عمل کند .این نوع ناخالصی ها را به علت اینکه الکترونهای رسانش را فراهم می کند ، ناخالصی های دهنده می نامیم .نیم رسانای نوعn،تنها از این نظر منفی است که تعداد الکترونهای موجود دران بیش از تعداد لازم برای تشکیل پیوند در بلوراست .ولی بلور از نظر تعداد الکتریکی خنثی است .
لیلی زمانی بیدختی دبیر شیمی
منبع : سازمان آموزش و پرورش استان خراسان
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید بلیط هواپیما
روز معلم معلمان ایران بابک زنجانی مجلس مجلس شورای اسلامی خلیج فارس دولت دولت سیزدهم حجاب رهبر انقلاب شورای نگهبان
شهرداری تهران تهران سلامت هواشناسی پلیس سیل آموزش و پرورش قوه قضاییه فضای مجازی دستگیری شورای شهر تهران سازمان هواشناسی
قیمت دلار خودرو قیمت خودرو بانک مرکزی دلار ایران خودرو سایپا چین بازار خودرو قیمت طلا تورم مالیات
مسعود اسکویی تلویزیون سریال سینما موسیقی سعید آقاخانی سینمای ایران فیلم دفاع مقدس تئاتر نون خ رسانه ملی
رژیم صهیونیستی اسرائیل آمریکا غزه فلسطین جنگ غزه حماس نوار غزه روسیه عربستان نتانیاهو اوکراین
فوتبال استقلال پرسپولیس رئال مادرید بایرن مونیخ سپاهان تراکتور لیگ قهرمانان اروپا باشگاه استقلال تیم ملی فوتسال ایران فوتسال بازی
وزیر ارتباطات تبلیغات اپل ناسا گوگل نخبگان ویروس آیفون ماه نمایشگاه خودرو
خواب بارندگی دیابت کاهش وزن ویتامین قهوه مسمومیت چاقی داروخانه بارداری