جمعه, ۳۱ فروردین, ۱۴۰۳ / 19 April, 2024
مجله ویستا
آشنایی با بیماری آنکارا(سندرم آب آوردگی پریکارد و هپاتیت)
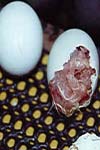
سندرم آب آوردگی و هپاتیت (HHS) یك بیماری عفونی و مسری است كه از علائم مشخصه آن درصد ابتلا و درصد تلفات بالا است. مایعات پریكارد افزایش یافته و هپاتیت با كانونهای نكروزی زیادی دیده می شود. علت اختصاصی این سندرم آدنوویروس گروه یك می باشد . بعضی مضاعف سیستم ایمنی مانندن گامبور، مارك و كم خونی عفونی جوجه ها تایید نشده است. ولی اعتقاد بر این است كه اثر این بیماری ها در بروز بیماری آنكارا مهم می باشد. برآورد اقتصادی بیماری آنكارا مشكل است. بدلیل اینكه در مناطقی كه این بیماری بروز می كند ممكن است همراه با سایر بیماریهای طیور از قبیل نیوكاسل و نوژیك و مایكوپلاسموزیس سالمولوزیس، مارك و آنفلوانزا باشد. میزان شروع و شدت بیماری (HHS) بستگی به تراكم مرغداری ها درمنطقه دارد. سندرم آب آوردگی پریكارد در نزدیكی كراچی تشخیص داده شد. به دلیل اینكه بیماری (HHS) در این منطقه جغرافیایی به خصوص تشخیص داده شده به آن بیماری آنگارا گفته می شود. در منطقه نزدیك اورابان كه در مركز پاكستان واقع است گله های جوجه گوشتی حساس كه به صورت متراكم می باشند در مدت ۱۲ ماه بیماری سریعاً در آنها منتشر شد. شیوع بیماری (HHS) در مكزیك در سال ۱۹۸۹ در ایالت كونرتارو از مناطق با مرغداری های متراكم می باشد گزارش شده است و در سال ۱۹۹۰ به ۵ ایالتی كه پرورش طیور گوشتی داشتند گسترش پیدا كرد . در طی سال ۱۹۹۴ بیماری (HHS) در مناطق پر تراكم پرورش طیور گوشتی در دهلی نو در هندوستان ظاهر گردید. بیماری آنگارا همچنین در كشورهای عراق و شیلی و پرو تشخیص داده شده است. جوجه های گوشتی در سن ۳ تا ۵ هفتگی حساس هستند.این بیماری در مرغداری مادر نابالغ و مرغان تخمگذار تجارتی هم مشاهده می شود.
سبب شناسی
در ابتدا علت بیماری (HHS) به یك مسمومیت و یا اختلال تغذیه ای نسبت داده می شد. از طریق تزریق كبد هموژن شده طیور آلوده به جوجه های گوشتی ثابت شد كه علت بیماری یك عامل عفونی است. در مشاهدات بعدی در سلولهای كبدی گنجیدگی داخل هسته ای بازوفیلیك مشاهده گردید. در نتیجه سعی شده یك عامل ویروسی جدا گردد. در سال ۱۹۸۸ مشخص شد كه یك آدنو ویروس عامل این بیماری است.بوسیله میكروسكوپ الكترونیك از كبد هموژن شده می توان برای مشخص كردن نشانه های اختصاصی ویرونها استفاده كرد.كبد و ریه اخذ شده از پرندگان آلوده زمانی كه با آنتی سرم اختصاصی مجاور شود . در آزمایش آگارژل مثبت می گردد. بافت كبد هموژن شده و تسویه شده از پرندگان آلوده را به داخل پرده كوریونیك و كیسه زرده تخم مرغهای (SPF) در سن ۸ روزگی جنینی تزریق می گردد. جنینن ۴ تا ۷ روز بعد تلف می شود. مطالعات در سال ۱۹۹۱ نشان داد كه جهت غیر فعال كردن سوسپانسیون كبد بوسیله اتر یا كلروفرم آدنو ویروسها غیر فعال نمی شود ولی محدود می گردند.تهیه سوسپانسیون كبد از پرنده آلوده و نگهداری آن در درجه حرارت ۶۰ درجه سانتیگراد در مدت ۳۰ دقیقه سبب غیر فعال شدن ادنو ویروس می گردد.ظاهراً مقاومت حرارتی یك مطالعه در مورد عوامل خطر ایجاد بیماری (HHS) در گله هی گوشتی در پاكستان انجام شده است.ورود واكسیناتور ها به فارمها ، گله ها به شیوع بیماری حساس می نماید.میزان آلودگی از طریق تزریقات زیر جلدی و یا داخل عضله برابر با آلودگی طبیعی از طریق هوا ، آب و یا مدفوع می باشد.
علائم و درصد ابتلا و تلفات
در مجاورت اسلام آباد پاكستان از ۱۳۱ گله كه دارای ۱۳۵ واحد نیمچه گوشتی بوده اند یك شیوع ۴۶ درصدی گزارش شده است. درصد تلفات ناشی از این بیماری در گله های نیمچه گوشتی غیر واكسینه و گله های مادر نابالغ اگر با بیماری نیوكاسل و لوژنیك و بیماری گامبورو با پاتوژنیسته بالا و بیماریهای آروزیو مانند مایكوپلاسموز همراه باشد بیش از ۸۰ درصد است . معمولاً دوره عفونت بین ۹ تا ۱۴ روز است، درصد ابتلا ۱۰ تا ۳۰ درصد بوده و روزانه ۳ تا ۵ درصد تلفات وجود دارد. در شرایط آزمایشگاهی گبد هموژن شده ای كه از گله آلوده اخذش ده است را به تعداد جوجه تبدیل گردد. تلفات ۲ تا ۴ روز بعد ایجاد شده ، درصد تلفات ۳۰ تا ۷۰ درصد بوده و بستگی به میزان تیتر عامل بیماری دارد كه جوجه ها دریافت داشته اند.
گله هایی كه بیماری (HHS) را نشان می دهند دارای علائم كلینیكی نیستند. شروع ناگهانی تلفات ، بی حالی، ازدحام كردن، پرهای ژولیده و زرد و ریزش موكوئید از علائم مشخصه آن است .در طیور مبتلا میزان هموگلوبین و PCV و اریتروسیتها و مجموعه لوكوسیدها كاهش پیدا می كند . در اثر استرس و عفونتهای ویروسی لنفوسیتها كاهش و هتروفیلها افزایش پیدا می كنند.در طیور بیمار به دلیل تخریب كبد پروتئین خون و آلبومین كاهش پیدا می كند. این مسئله احتمالاً دلیل افزایش هیدروپریكاردیوم می باشد.اگر این بیماری با كمخونی شدید بروز كند معمولاً توأم با بیماری كمخونی عفونی جوجه ها و یا گامبرو با حدت بالا است.
در پرندگان بیمار میزان لاكتیك ، دهیدروژناز، آلكالین فسفاتاز و آلانین ترانس آمیناز كه بواسطه تخریب كبد و كلیه ایجاد می گردد افزایش می یابد.مهمترین ضایعه پس از مرگ كه بر روی لاشه دیده می شود وجود بیش از ۱۰ سی سی محلول ترانسو دای شفاف در كیسه اطراف قلب می باشد. در لاشه پر خونی عمومی و ادم ریه وجود دارد. كبد و كلیه ها بزرگ و رنگ پریده و ترد و شكننده می گردند. در شرایط آزمایشگاهی در طیور بیمار نكروز نیوكارد و كبد مشاهده می شود . خونریزی پتشی ممكن است بر روی پریكارد و كپسول كبد دیده شود.ضایعات بافتی در داخل قلب شامل ادن و دژنرسانز و نكروز ملایم عضله قلب و نفوذ سلولهای منو نوكلئار و خروج اریتروسیدهاست. در كبد اینكلوژن بادی بازوفیلیك در داخل هسته های هپاتوسیت و نفوذ سلولهای منو نوكلئار و نكروز انعقادی چند كانونی وجود دارد. ممكن است در منطقه وسیعی از اپی تلیوم كلیه نیز نكروز دیده شود.
تشخیص
آب آوردگی پریكارد همراه با گنجیدگی های بازوفیلیك داخل هسته ای سلولهای كبد دال بر وجود بیماری HHS است. تشخیص قطعی براساس جاسازی آدنوویروس از سلولهای كبد جنین جوجه های آلوده می باشد. این روش حساس تر از روش تزریق به كیسه زرده جنین جوجه ۸ روزه است. بوسیله آزمایشات سیتوپاتولوژی می توان در كشت بافتی وجود آدنوویروس ها را تشخیص داد. آدنوویروس ها را می توان بوسیله میكروسكوپ الكترونی (EM) و یا سرم نوترالیزشن تشخیص داد.درمان
روش های مختلفی در بین آدنوویروس ها وجود دارد. زمانی كه كبد هموژن شده را با ۴۵۰۰۰ دور به مدت ۹۰ دقیقه سانتروفیژ كنند ذرات معلق شده سانتریفوژ كنند ذرات معلق شده بیماریزا بوده ولی مایع رو فاقد قدرت عفونت زائی است . افزودن آدنوویروس ایجاد كننده هپاتیت با گنجیدگی داخل سلولی به مایه رو موجب احیا قدرت عفونت زائی آن می گردد كه این امر نشان دهنده حضور یك عامل ویروسی مجزا بغیر از آدنوویروس اولیه می باشد.از مطالعات بعدی در مكزیك كه در سال ۱۹۹۴ انجام شد چنین استنباط می گردد كه به علت عدم مهار توسط ۵ - برومو دی اكسید یوریدین یك ویروس RNA به عنوان عامل اضافی مطرح می باشد. این عامل سبب بروز یك حباب كوچك در كشت سلولهای كبد و كلیه جوجه می گرد.
پیچیدگی بیشتری در تعریف اتینوژی این بیماری وجود دارد زیرا در مناطقی كه بیماری (HHS) وجود دارد بیماریها با پاتوژنیسته زیاد از قبیل گامبورو و كم خونی عفونی جوجه ها نیز دیده می شود.ویروس عامل این بیماری از كبد هموژن شده گله های آلوده در پاكستان جدا شده است. عامل آن آدنوویروس گردیده یك سروتیپ ۴ تا ۱۱ می باشد. اخیراً بیماری (HHS) به صورت آزمایشی بوسیله آدنوویروس طیور سروتیپ های (Strain PARC-۱) و (Strain DCV-۹) ۸ در جوجه هایحساس بعد از آلودگی، گنجیدگی های داخل سلولهای كبد و هم آب آوردگی پریكارد مشاهده می شود. سروتیپ ۴ آدنوویروس به بافت لنفوئیدی تمایل دارد در نتیجه ضعف سیستم ایمنی ایجاد می گردد. تضاد اختلاف بین فرضیه های تك ویروسی و دو ویروسی پس از انجام مطالعات اپیدمیولوژی و آزمایشگاهی رفع خواهد شد.
بیماریزایی و اپیدمیولوژی
میزبانهای آزمایشگاهی و طبیعی:
جوجه های نابالغ میزبانهای طبیعی هستند. بیماری HHS بیشتر در سنین بین ۳ تا ۵ هفتگی در جوجه های گوشتی مشاهده می شود. یك بیماری شبیه HHS در كبوترها در پاكستان گزارش شده است.
انتقال
عامل بیماری HHS كه مورد بحث می باشد آدنوویرس گروه یك است و انتقال آن هم عمودی و هم افقی است. آدنوویروس در گله های مادر تا زمان بلوغ باقی می ماند و در اثر صعف سیستم ایمنی و یا استرس دفع می گردد. جوجه هایی كه از گله های مادر آلوده تولید می شوند بعد از ۳ هفتگی ممكن است ویروس را تا ۱۴ هفته دفع كنند. انتقال افقی ویروس در گله هایی كه مسائل بهداشتی را رعایت نمی كنند رخ می دهد. تكثیر ویروس در دستگاه گوارش انجام می شود. آلودگی مدفوع لباس، كفش و وسائل (از قبیل ظروف و وسائل نقلیه) ممكن است باعث انتقال عامل بیماری شوند. در گله های طیور در پاكستان به دلیل عدم وجود مسائل بهداشتی و وجود فارمهای بسته چند سنی و وجود پرندگان بومی عامل بیماری انتقال پیدا می كند.واكسنهایی كه از جنینهای آلوده تهیه می شود ممكن است منشا آلودگی باشد. درمان اختصاصی برای این بیماری وجود ندارد. ولی در زمان بروز بیماری از یدوفور در آب آشامیدنی به میزان ۰/۱ تا ۰/۰۷ درصد استفاده می شود. درصد تلفات و شدت بیماری كاهش پیدا خواهد كرد.
پیشگیری و كنترل:
در پاكستان و هند و مكزیك حفظ شرایط بهداشتی نه عمل است و نه اقتصادی و مسلماً آدنوویروس از واحدهای نیمچه گوشتی جدا خواهد شد.
علل ایجاد بیماری عبارتند از: چند سنی بودن گله، فروش پرندگان زنده، انتقال غذا بوسیله كیسه ها و افرادی كه پرندگان اهلی را نگه داری می كنند. گله های ماد باید بوسیله رعایت شرایط بهداشتی مناسب از عفونت محافظت شوند. فاصله فارمهای صنعتی از یكدیگر باید حداقل ۲ كیلومتر باشد و از سیستم All out - All in در پرورش استفاده شود تا از آلودگی فارمهای سالم جلوگیری بعمل اید. مواد غذایی باید بصورت عمده نگهداری شوند و قبل از ورود آن به فارم هیچكس نباید با مواد غذایی تماس داشته باشد. در گله های مادر و جوجه های آن از واكسن زنده استفاده می شود.واكسن ها می بایست بر اساس استانداردهای بین المللی تولید گردند و باید عاری از عوامل پاتوژن از قبیل آدنوویروس ها و ویروس كم خونی عفونی طیور باشد. در مناطقی كه بیماری HHS اندمیك می باشد ضروری است گله ها را در برابر آدنوویروس اولیه كه مسئول ایجاد این بیماری است محافظت كرد. واكسن كشته فرم الدئید كه از كبد هموژن شده جوجه SPF كه به وسیله فرم آلدئید از درصد غیر فعال شده تهیه می گردد. اثر این واكسن در یك منطقه كه دارای ۲۸ گله با ظرفیت ۱۰۰۰۰۰ قطعه نیمچه گوشتی می باشد مورد مطالعه قرار گرفته است.گله هایی كه واكسینه شده اند و بصورت طبیعی در معرض آلودگی قرار گرفته اند بیماری HHS را كمتر نشان می دهند تلفات آن به ۲/۱ درصد می رسد. گله هایی كه واكسن دریافت نكرده اند تلفات آنها بالغ بر ۲۰ درصد می باشد.پس از واكسیناسیون در منطقه راولپندی در یك میلیون قطعه نیمچه گوشتی درصد تلفات تقریباً به ۴ درصد رسیده است و در گله های تجارتی تولید گردیده نشان داده شده كه واكسن غیر فعال فرمالینه در امولسیون روغنی گله هیی را كه به صورت طبیعی در معرض بیماری بوده اند را ۱۰۰ درصد محافظت می كند و ضایعات هستوپاتولوژی در آنها وجود ندارد. میزان محافظت ۴ واكسن غیر فعال دیگر كه از سویه DCV-۹۴ تهیه شده در گله هایی كه با ویروس فیلد برخورد داشته اند بین صفر تا ۴۵ درصد است.در جوجه هایی كه واكسن دریافت نكرده اند تلفات به ۸۰ درصد می رسد. در همه جوجه هایی كه واكسینه شده اند آنتی بادی بوسیله مهار ایمینوفلورسانس مشخص می گردد. پس از واكسیناسیون جوجه ها بر علیه بیماری HHS پاسخ ایمنی مناسبی ایجاد می شود و زمانی كه گله با عامل بیماری برخورد می كند جوجه ها زنده می مانند
ترجمه دكتر داریوش خسروی (برگرفته از مجله جهان مرغداری)
سبب شناسی
در ابتدا علت بیماری (HHS) به یك مسمومیت و یا اختلال تغذیه ای نسبت داده می شد. از طریق تزریق كبد هموژن شده طیور آلوده به جوجه های گوشتی ثابت شد كه علت بیماری یك عامل عفونی است. در مشاهدات بعدی در سلولهای كبدی گنجیدگی داخل هسته ای بازوفیلیك مشاهده گردید. در نتیجه سعی شده یك عامل ویروسی جدا گردد. در سال ۱۹۸۸ مشخص شد كه یك آدنو ویروس عامل این بیماری است.بوسیله میكروسكوپ الكترونیك از كبد هموژن شده می توان برای مشخص كردن نشانه های اختصاصی ویرونها استفاده كرد.كبد و ریه اخذ شده از پرندگان آلوده زمانی كه با آنتی سرم اختصاصی مجاور شود . در آزمایش آگارژل مثبت می گردد. بافت كبد هموژن شده و تسویه شده از پرندگان آلوده را به داخل پرده كوریونیك و كیسه زرده تخم مرغهای (SPF) در سن ۸ روزگی جنینی تزریق می گردد. جنینن ۴ تا ۷ روز بعد تلف می شود. مطالعات در سال ۱۹۹۱ نشان داد كه جهت غیر فعال كردن سوسپانسیون كبد بوسیله اتر یا كلروفرم آدنو ویروسها غیر فعال نمی شود ولی محدود می گردند.تهیه سوسپانسیون كبد از پرنده آلوده و نگهداری آن در درجه حرارت ۶۰ درجه سانتیگراد در مدت ۳۰ دقیقه سبب غیر فعال شدن ادنو ویروس می گردد.ظاهراً مقاومت حرارتی یك مطالعه در مورد عوامل خطر ایجاد بیماری (HHS) در گله هی گوشتی در پاكستان انجام شده است.ورود واكسیناتور ها به فارمها ، گله ها به شیوع بیماری حساس می نماید.میزان آلودگی از طریق تزریقات زیر جلدی و یا داخل عضله برابر با آلودگی طبیعی از طریق هوا ، آب و یا مدفوع می باشد.
علائم و درصد ابتلا و تلفات
در مجاورت اسلام آباد پاكستان از ۱۳۱ گله كه دارای ۱۳۵ واحد نیمچه گوشتی بوده اند یك شیوع ۴۶ درصدی گزارش شده است. درصد تلفات ناشی از این بیماری در گله های نیمچه گوشتی غیر واكسینه و گله های مادر نابالغ اگر با بیماری نیوكاسل و لوژنیك و بیماری گامبورو با پاتوژنیسته بالا و بیماریهای آروزیو مانند مایكوپلاسموز همراه باشد بیش از ۸۰ درصد است . معمولاً دوره عفونت بین ۹ تا ۱۴ روز است، درصد ابتلا ۱۰ تا ۳۰ درصد بوده و روزانه ۳ تا ۵ درصد تلفات وجود دارد. در شرایط آزمایشگاهی گبد هموژن شده ای كه از گله آلوده اخذش ده است را به تعداد جوجه تبدیل گردد. تلفات ۲ تا ۴ روز بعد ایجاد شده ، درصد تلفات ۳۰ تا ۷۰ درصد بوده و بستگی به میزان تیتر عامل بیماری دارد كه جوجه ها دریافت داشته اند.
گله هایی كه بیماری (HHS) را نشان می دهند دارای علائم كلینیكی نیستند. شروع ناگهانی تلفات ، بی حالی، ازدحام كردن، پرهای ژولیده و زرد و ریزش موكوئید از علائم مشخصه آن است .در طیور مبتلا میزان هموگلوبین و PCV و اریتروسیتها و مجموعه لوكوسیدها كاهش پیدا می كند . در اثر استرس و عفونتهای ویروسی لنفوسیتها كاهش و هتروفیلها افزایش پیدا می كنند.در طیور بیمار به دلیل تخریب كبد پروتئین خون و آلبومین كاهش پیدا می كند. این مسئله احتمالاً دلیل افزایش هیدروپریكاردیوم می باشد.اگر این بیماری با كمخونی شدید بروز كند معمولاً توأم با بیماری كمخونی عفونی جوجه ها و یا گامبرو با حدت بالا است.
در پرندگان بیمار میزان لاكتیك ، دهیدروژناز، آلكالین فسفاتاز و آلانین ترانس آمیناز كه بواسطه تخریب كبد و كلیه ایجاد می گردد افزایش می یابد.مهمترین ضایعه پس از مرگ كه بر روی لاشه دیده می شود وجود بیش از ۱۰ سی سی محلول ترانسو دای شفاف در كیسه اطراف قلب می باشد. در لاشه پر خونی عمومی و ادم ریه وجود دارد. كبد و كلیه ها بزرگ و رنگ پریده و ترد و شكننده می گردند. در شرایط آزمایشگاهی در طیور بیمار نكروز نیوكارد و كبد مشاهده می شود . خونریزی پتشی ممكن است بر روی پریكارد و كپسول كبد دیده شود.ضایعات بافتی در داخل قلب شامل ادن و دژنرسانز و نكروز ملایم عضله قلب و نفوذ سلولهای منو نوكلئار و خروج اریتروسیدهاست. در كبد اینكلوژن بادی بازوفیلیك در داخل هسته های هپاتوسیت و نفوذ سلولهای منو نوكلئار و نكروز انعقادی چند كانونی وجود دارد. ممكن است در منطقه وسیعی از اپی تلیوم كلیه نیز نكروز دیده شود.
تشخیص
آب آوردگی پریكارد همراه با گنجیدگی های بازوفیلیك داخل هسته ای سلولهای كبد دال بر وجود بیماری HHS است. تشخیص قطعی براساس جاسازی آدنوویروس از سلولهای كبد جنین جوجه های آلوده می باشد. این روش حساس تر از روش تزریق به كیسه زرده جنین جوجه ۸ روزه است. بوسیله آزمایشات سیتوپاتولوژی می توان در كشت بافتی وجود آدنوویروس ها را تشخیص داد. آدنوویروس ها را می توان بوسیله میكروسكوپ الكترونی (EM) و یا سرم نوترالیزشن تشخیص داد.درمان
روش های مختلفی در بین آدنوویروس ها وجود دارد. زمانی كه كبد هموژن شده را با ۴۵۰۰۰ دور به مدت ۹۰ دقیقه سانتروفیژ كنند ذرات معلق شده سانتریفوژ كنند ذرات معلق شده بیماریزا بوده ولی مایع رو فاقد قدرت عفونت زائی است . افزودن آدنوویروس ایجاد كننده هپاتیت با گنجیدگی داخل سلولی به مایه رو موجب احیا قدرت عفونت زائی آن می گردد كه این امر نشان دهنده حضور یك عامل ویروسی مجزا بغیر از آدنوویروس اولیه می باشد.از مطالعات بعدی در مكزیك كه در سال ۱۹۹۴ انجام شد چنین استنباط می گردد كه به علت عدم مهار توسط ۵ - برومو دی اكسید یوریدین یك ویروس RNA به عنوان عامل اضافی مطرح می باشد. این عامل سبب بروز یك حباب كوچك در كشت سلولهای كبد و كلیه جوجه می گرد.
پیچیدگی بیشتری در تعریف اتینوژی این بیماری وجود دارد زیرا در مناطقی كه بیماری (HHS) وجود دارد بیماریها با پاتوژنیسته زیاد از قبیل گامبورو و كم خونی عفونی جوجه ها نیز دیده می شود.ویروس عامل این بیماری از كبد هموژن شده گله های آلوده در پاكستان جدا شده است. عامل آن آدنوویروس گردیده یك سروتیپ ۴ تا ۱۱ می باشد. اخیراً بیماری (HHS) به صورت آزمایشی بوسیله آدنوویروس طیور سروتیپ های (Strain PARC-۱) و (Strain DCV-۹) ۸ در جوجه هایحساس بعد از آلودگی، گنجیدگی های داخل سلولهای كبد و هم آب آوردگی پریكارد مشاهده می شود. سروتیپ ۴ آدنوویروس به بافت لنفوئیدی تمایل دارد در نتیجه ضعف سیستم ایمنی ایجاد می گردد. تضاد اختلاف بین فرضیه های تك ویروسی و دو ویروسی پس از انجام مطالعات اپیدمیولوژی و آزمایشگاهی رفع خواهد شد.
بیماریزایی و اپیدمیولوژی
میزبانهای آزمایشگاهی و طبیعی:
جوجه های نابالغ میزبانهای طبیعی هستند. بیماری HHS بیشتر در سنین بین ۳ تا ۵ هفتگی در جوجه های گوشتی مشاهده می شود. یك بیماری شبیه HHS در كبوترها در پاكستان گزارش شده است.
انتقال
عامل بیماری HHS كه مورد بحث می باشد آدنوویرس گروه یك است و انتقال آن هم عمودی و هم افقی است. آدنوویروس در گله های مادر تا زمان بلوغ باقی می ماند و در اثر صعف سیستم ایمنی و یا استرس دفع می گردد. جوجه هایی كه از گله های مادر آلوده تولید می شوند بعد از ۳ هفتگی ممكن است ویروس را تا ۱۴ هفته دفع كنند. انتقال افقی ویروس در گله هایی كه مسائل بهداشتی را رعایت نمی كنند رخ می دهد. تكثیر ویروس در دستگاه گوارش انجام می شود. آلودگی مدفوع لباس، كفش و وسائل (از قبیل ظروف و وسائل نقلیه) ممكن است باعث انتقال عامل بیماری شوند. در گله های طیور در پاكستان به دلیل عدم وجود مسائل بهداشتی و وجود فارمهای بسته چند سنی و وجود پرندگان بومی عامل بیماری انتقال پیدا می كند.واكسنهایی كه از جنینهای آلوده تهیه می شود ممكن است منشا آلودگی باشد. درمان اختصاصی برای این بیماری وجود ندارد. ولی در زمان بروز بیماری از یدوفور در آب آشامیدنی به میزان ۰/۱ تا ۰/۰۷ درصد استفاده می شود. درصد تلفات و شدت بیماری كاهش پیدا خواهد كرد.
پیشگیری و كنترل:
در پاكستان و هند و مكزیك حفظ شرایط بهداشتی نه عمل است و نه اقتصادی و مسلماً آدنوویروس از واحدهای نیمچه گوشتی جدا خواهد شد.
علل ایجاد بیماری عبارتند از: چند سنی بودن گله، فروش پرندگان زنده، انتقال غذا بوسیله كیسه ها و افرادی كه پرندگان اهلی را نگه داری می كنند. گله های ماد باید بوسیله رعایت شرایط بهداشتی مناسب از عفونت محافظت شوند. فاصله فارمهای صنعتی از یكدیگر باید حداقل ۲ كیلومتر باشد و از سیستم All out - All in در پرورش استفاده شود تا از آلودگی فارمهای سالم جلوگیری بعمل اید. مواد غذایی باید بصورت عمده نگهداری شوند و قبل از ورود آن به فارم هیچكس نباید با مواد غذایی تماس داشته باشد. در گله های مادر و جوجه های آن از واكسن زنده استفاده می شود.واكسن ها می بایست بر اساس استانداردهای بین المللی تولید گردند و باید عاری از عوامل پاتوژن از قبیل آدنوویروس ها و ویروس كم خونی عفونی طیور باشد. در مناطقی كه بیماری HHS اندمیك می باشد ضروری است گله ها را در برابر آدنوویروس اولیه كه مسئول ایجاد این بیماری است محافظت كرد. واكسن كشته فرم الدئید كه از كبد هموژن شده جوجه SPF كه به وسیله فرم آلدئید از درصد غیر فعال شده تهیه می گردد. اثر این واكسن در یك منطقه كه دارای ۲۸ گله با ظرفیت ۱۰۰۰۰۰ قطعه نیمچه گوشتی می باشد مورد مطالعه قرار گرفته است.گله هایی كه واكسینه شده اند و بصورت طبیعی در معرض آلودگی قرار گرفته اند بیماری HHS را كمتر نشان می دهند تلفات آن به ۲/۱ درصد می رسد. گله هایی كه واكسن دریافت نكرده اند تلفات آنها بالغ بر ۲۰ درصد می باشد.پس از واكسیناسیون در منطقه راولپندی در یك میلیون قطعه نیمچه گوشتی درصد تلفات تقریباً به ۴ درصد رسیده است و در گله های تجارتی تولید گردیده نشان داده شده كه واكسن غیر فعال فرمالینه در امولسیون روغنی گله هیی را كه به صورت طبیعی در معرض بیماری بوده اند را ۱۰۰ درصد محافظت می كند و ضایعات هستوپاتولوژی در آنها وجود ندارد. میزان محافظت ۴ واكسن غیر فعال دیگر كه از سویه DCV-۹۴ تهیه شده در گله هایی كه با ویروس فیلد برخورد داشته اند بین صفر تا ۴۵ درصد است.در جوجه هایی كه واكسن دریافت نكرده اند تلفات به ۸۰ درصد می رسد. در همه جوجه هایی كه واكسینه شده اند آنتی بادی بوسیله مهار ایمینوفلورسانس مشخص می گردد. پس از واكسیناسیون جوجه ها بر علیه بیماری HHS پاسخ ایمنی مناسبی ایجاد می شود و زمانی كه گله با عامل بیماری برخورد می كند جوجه ها زنده می مانند
ترجمه دكتر داریوش خسروی (برگرفته از مجله جهان مرغداری)
منبع : موسسه مرغداری ایران
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
اصفهان اسرائیل ایران حمله ایران به اسرائیل انفجار ایران و اسرائیل ارتش جمهوری اسلامی ایران دولت حسین امیرعبداللهیان جنگ ایران و اسرائیل دولت سیزدهم جنگ
سیل زلزله هواشناسی قتل تهران ترکیه سیلاب فضای مجازی قوه قضاییه شهرداری تهران سازمان هواشناسی پلیس
فرودگاه قیمت خودرو فرودگاه مهرآباد یارانه قیمت طلا بانک مرکزی خودرو بازار خودرو ایران خودرو قیمت دلار بورس دلار
تلویزیون احسان علیخانی تبلیغات سینمای ایران کتاب دفاع مقدس سریال تئاتر موسیقی
چین دانشگاه آزاد اسلامی
رژیم صهیونیستی فلسطین آمریکا عملیات وعده صادق غزه جنگ غزه روسیه وعده صادق حماس اسراییل حزب الله لبنان طوفان الاقصی
پرسپولیس فوتبال استقلال صنعت نفت آبادان لیگ قهرمانان اروپا بازی رئال مادرید لیگ برتر منچسترسیتی بارسلونا کشتی فرنگی سپاهان
گوگل هوش مصنوعی سامسونگ تلگرام فناوری اپل آیفون وزیر ارتباطات ناسا
سلامت چاقی پیاده روی درمان و آموزش پزشکی پزشک چای